 |
|
Состояние, при котором электроны спарены и их суммарный спиновой момент равен нулю, называется СИНГЛЕТНЫМ.
Лабораторная работа № 4
УСТРОЙСТВО И ПРИНЦИП РАБОТЫ СПЕКТРОГРАФА
Цель занятия: Изучить функциональную структуру спектроскопа (спектрографа), виды спектров, понятия количественного и качественного спектрального анализа, применение в фармации и биологии.
Краткая теория
Спектральные методы исследования находят в настоящее время широкое применение в лабораторной практике. Свет представляет собой совокупность электромагнитных волн очень высокой частоты. Если на его пути поставить призму, то лучи будут преломляться под разными углами
(дисперсия), и дают спектры. Различают спектры по происхождению (атомные, молекулярные) по способу получения (испускания, поглощения), по виду (сплошной, линейчатый, полосатый).
I.Атомные спектры.
Состояние электрона в атоме характеризуется волновой функцией, которая содержит безразмерные величины - квантовые числа. Квантовые числа могут принимать ряд целочисленных значений. Этими числами задается атомная орбиталь, распределение электронов по атомным орбиталям и определяется электронная конфигурация атома.
Основным состоянием атомной системы является состояние с наименьшей энергией.
Возбужденным состоянием атомной системы называют состояние, в котором полная энергия больше энергии основного состояния. Энергия электронов атома тоже зависит от квантовых чисел и может принимать только строго определенные значения энергии Е, которые называются энергетическими уровнями. Для одноэлектронного атома энергетические уровни атома и электрона совпадают.
Поглощение и испускание энергии атома связано с квантовыми переходами электронов с одного уровня на другой.
Различаются два типа переходов:
I- с излучением или поглощением энергии квантов.
II.-без излучения или поглощения электромагнитной энергии.
Излучаемая атомами энергия составляет спектр излучения, поглощаемая- спектр поглощения.
Квантовые переходы не могут происходить между любыми уровнями.
Существуют правила отбора или запрета, формирующие условия, при которых переходы возможны или невозможны (маловероятны).
В атомах в результате взаимодействия электронов между собой картина энергетических уровней усложняются. Энергия атома в целом определяется заданием квантовых чисел: n – главнее квантовое число, определяет уровни энергии электрона и L - орбитальное квантовое число, характеризует орбитальный момент электрона относительно ядра. Совокупность квантовых чисел n и L и определяет электронную конфигурацию атома. Как правило, каждой конфигурации принадлежит набор энергетических уровней.
При переходе между уровнями излучается или поглощается квант электромагнитной энергии, частота которого определяется формулой Планка: hv=Е2-Е1
II.Молекулярные спектры 
Молекулярные спектры значительно сложнее атомных. Рассмотрим энергетические уровни простейшей двухатомной молекулы. Каждому электронному состоянию соответствует своя система колебательных уровней Viодно из которых основное и несколько возбужденных. Каждому колебательному уровню Vi соответствует своя система вращательных подуровней Ii.
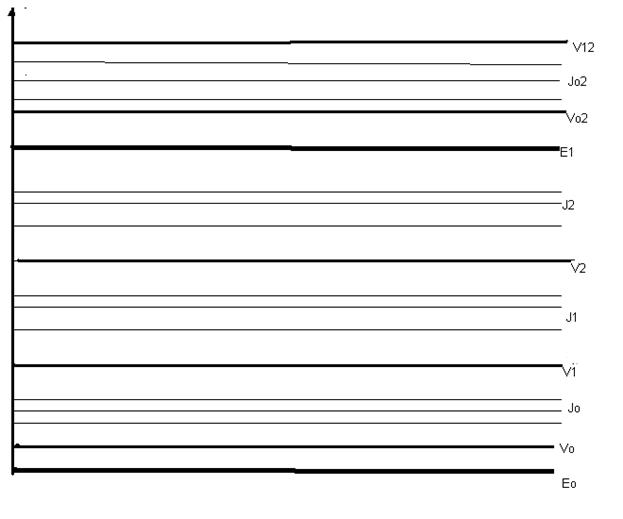
Рис.1 Энергетические уровни молекул
Чисто вращательные молекулярные спектры дают вещества в газообразном состоянии, чисто колебательные, а тем более чисто электронные спектры молекул получить нельзя, т.к. изменяется все три вида движения молекул. Колебательно-вращательные спектры можно получить при любом агрегатном состоянии.
В возбужденном состоянии молекула резко отличается по своим свойствам и строению, по сравнению с основным состоянием.
Состояние, при котором электроны спарены и их суммарный спиновой момент равен нулю, называется СИНГЛЕТНЫМ.
Состояние, при котором спины электронов параллельны и их суммарный спиновой момент отличен от нуля, называется ТРИПЛЕТНЫМ.
Основной невозбужденный уровень обычно синглетный S0, возбужденные электронные состояния могут быть синглетными S1*, S2*, S3З и триплетными Т1,Т2, Т3 и т.д. Уровни S0, S1…S0 называются синглетными, при переходах между ними спин электрона не меняется, переход в триплетное состояние сопровождается обращением спина электрона. Молекула, попавшая на верхние колебательные уровни любого возбужденного состояния, быстро теряет энергию при столкновениях (колебательная релаксация) и переходит на 0-й колебательный уровень данного состояния. Безизлучательный переход между электронными состояниями разной мультиплетности называется ИНТЕРКОМБИНАЦИОННОЙ КОНВЕРСИЕЙ(рис.2).
Безизлучательный переход между электронными состояниями одинаковой мультиплетности называется ВНУТРЕННЕЙ КОНВЕРСИЕЙ.
Поглощение молекулой света процесс квантовый: энергия кванта должна быть равна разности энергии уровней, между которыми совершается переходы hv=Е2-Е1
Кроме того переход должен удовлетворять правилам отбора.
Такие переходы называются РАЗРЕШЕННЫМИ, а остальные - ЗАПРЕЩЕННЫМИ.

 Поглотив квант, молекула становиться возбужденной (активизация). Дизактивация молекул происходит в результате процессов, указанных выше а также излучательных переходов с первого синглетного и первого триплетного уровня на основной (S1 S0 ; Т1 S0). Первый переход проявляется ФЛУОРЕСЦЕННИЕЙ, а второй ФОСФОРЕСЦЕНЦИЕЙ, Общее название для любых излучательных переходов в молекуле (флюоресценция и фосфоресценция) - ЛЮМИНЕСЦЕНЦИЯ.
Поглотив квант, молекула становиться возбужденной (активизация). Дизактивация молекул происходит в результате процессов, указанных выше а также излучательных переходов с первого синглетного и первого триплетного уровня на основной (S1 S0 ; Т1 S0). Первый переход проявляется ФЛУОРЕСЦЕННИЕЙ, а второй ФОСФОРЕСЦЕНЦИЕЙ, Общее название для любых излучательных переходов в молекуле (флюоресценция и фосфоресценция) - ЛЮМИНЕСЦЕНЦИЯ.
На рисунке 2 прямые стрелки – поглощательные и излучательные переходы, волнистые линии –безизлучательные переходы.
Около каждого уровня в клетках показано направление спина возбужденного электрона по отношению к спину оставшегося электрона.
. 

Рис..2 Электронные переходы в биомолекулах