 |
|
Газообразное состояние веществ
Фаза, фазовые состояния вещества
Фаза ‑ однородн часть системы, отделенная от др частей замкнутыми поверхностями. Осн особенностью фазы явл-ся наличие поверхности раздела. Фазой наз-ют однородн части системы, имеющие одинаковый состав, стр-е и св-ва, одинаковое агрегатн сост-е и отделенн от др составн частей поверхностями раздела. Фаза может состоять из одного вещества, н-р, вода-жидкость или вода – лед, или из нескольких веществ, например, водный раствор сахара, спиртовой раствор бензола. Число веществ, входящих в состав фазы наз- ют числом компонентов, причем число компонентов – это наименьшее число веществ, с помощью которых можно выразить состав любой фазы.
В каждой фазе любой компонент содержится в определенной концентрации, которую обычно выражают в молярных долях. Сумма молярных долей всех компонентов в данной фазе равна единице. Например, если в фазе имеется k компонентов, то справедливо соотношение:
N1 + N2 + N3 + … + Nk = 1,
где N1, N2, N3 … Nk – молярная доля соответственно 1-го, 2-го, 3-го и k-го компонента фазы.
В зависимости от внешних условий (температуры, давления), почти каждое вещество может находиться в одном из агрегатных (фазовых) состояний: твердом, жидком, газообразном и плазменном, которые отличаются друг от друга характером движения частиц и свойствами. Для всякого вещества существуют такие значения температуры, давления, объема и плотности, которые называются критическими (в совокупности критическими параметрами вещества), а состояние, соответствующее критическим параметрам называется критическим состоянием или критической точкой вещества. По современным представлениям критическая точка является изолированной точкой фазового перехода второго рода и одновременно конечной точкой перехода первого рода жидкость – пар. Критическая точка характеризуется рядом физических явлений (например, бесконечная сжимаемость, бесконечная теплоемкость при постоянном объеме и т.д.), которые протекают идентично во всех веществах и определяются самыми общими свойствами межмолекулярных сил.
Газообразное состояние веществ
Беспорядочно движущиеся в пространстве и относительно слабо взаимодействующие молекулы представляют собой газ. Газообразн состояние хар-ется сравнительно малыми силами межмолекулярного взаимодействия между молекулами, которые нах-ся на достаточно больших расстояниях друг от друга, вследствие чего газ занимает весь предоставленный ему объем.
Газы, находящиеся при температурах, значительно превышающих их критическую температуру и при давлениях, ниже критических, являются очень разреженными. Если газ очень разрежен, расстояния между молекулами очень велики, молекулярные силы взаимодействия ничтожно малы и ими можно пренебречь. При этом объем молекул составляет ничтожно малую часть объема, занимаемого газом, и межмолекулярных соударений практически не происходит. Такое предельно разреженное состояние газа называется идеальным. Состояние идеального газа можно описать объединенным газовым законом: 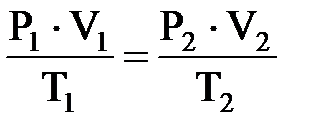 , где Р – давление; V – объем; Т – абсолютная температура. Для одного моль при нормальных условиях (н.у.) Р0 = 1,01325×105 Па; V0= 22,4 л/моль; Т = 273 К. Отсюда следует, что
, где Р – давление; V – объем; Т – абсолютная температура. Для одного моль при нормальных условиях (н.у.) Р0 = 1,01325×105 Па; V0= 22,4 л/моль; Т = 273 К. Отсюда следует, что  = 8,314 Дж/моль×К. Константу R называют универсальной газовой постоянной. В этом случае объединенный газовый закон будет иметь вид P×V = R×T. Для n молей газа оно становится таким: P×V = n×R×T. Данное уравнение носит название уравнения Менделеева-Клапейрона. У реальных газов наблюдаются отклонения значений Р и V от значений для идеальных газов, рассчитываемых по уравнениям газовых законов. Эти отклонения растут с увеличением давления и с понижением температуры. Если газ находится при условиях, отличных от идеальных, на его свойства начинают влиять межмолекулярные силы взаимодействия и объем, занимаемый самими молекулами. В этом случае свойства газов можно описать уравнением состояния реальных газов Ван-дер-Ваальса:
= 8,314 Дж/моль×К. Константу R называют универсальной газовой постоянной. В этом случае объединенный газовый закон будет иметь вид P×V = R×T. Для n молей газа оно становится таким: P×V = n×R×T. Данное уравнение носит название уравнения Менделеева-Клапейрона. У реальных газов наблюдаются отклонения значений Р и V от значений для идеальных газов, рассчитываемых по уравнениям газовых законов. Эти отклонения растут с увеличением давления и с понижением температуры. Если газ находится при условиях, отличных от идеальных, на его свойства начинают влиять межмолекулярные силы взаимодействия и объем, занимаемый самими молекулами. В этом случае свойства газов можно описать уравнением состояния реальных газов Ван-дер-Ваальса:  , где V – объем газа; a и b – постоянные Ван-дер-Ваальса. Постоянная а учитывает межмолекулярное взаимодействие, а постоянная b – объем молекул. Соответственно значение b растет с увеличением размера молекул, а значение a ‑ с увеличением энергии вандерваальсовского взаимодействия молекул. Поскольку уравнение является кубическим относительно V, то одному значению давления при некоторой температуре отвечают три значения объема – большее значение отвечает объему одного моль газа в момент начала конденсации, меньшее – объему одного моля жидкости в момент окончания конденсации газа, промежуточное значение не имеет определенного смысла. При понижении температуры ниже критического значения и при повышении давления газ начинает конденсироваться и под действием межмолекулярных сил между отдельными молекулами газ переходит в жидкое состояние. Процесс конденсации газов сопровождается значительным выделением энергии.
, где V – объем газа; a и b – постоянные Ван-дер-Ваальса. Постоянная а учитывает межмолекулярное взаимодействие, а постоянная b – объем молекул. Соответственно значение b растет с увеличением размера молекул, а значение a ‑ с увеличением энергии вандерваальсовского взаимодействия молекул. Поскольку уравнение является кубическим относительно V, то одному значению давления при некоторой температуре отвечают три значения объема – большее значение отвечает объему одного моль газа в момент начала конденсации, меньшее – объему одного моля жидкости в момент окончания конденсации газа, промежуточное значение не имеет определенного смысла. При понижении температуры ниже критического значения и при повышении давления газ начинает конденсироваться и под действием межмолекулярных сил между отдельными молекулами газ переходит в жидкое состояние. Процесс конденсации газов сопровождается значительным выделением энергии.