 |
|
IІI тарау. Ерітінділер. Буферлік ерітінділер
210!. Коллигативтік қасиеттерге жатады:
* ерітінді бетіндегі еріткіштің қаныққан бу қысымының төмендеуі, ерітіндінің қайнау температурасының жоғарылауы, ерітіндінің қату температурасының төмендеуі.
* ерітіндінің қайнау температурасының төмендеуі.
* ерітіндінің қату температурасының жоғарылауы.
* ерітіндінің қату температурасы және қайнау температурасы немесе ерітіндінің қатуы.
* ерітінді бетіндегі еріткіштің қаныққан бу қысымының жоғарылауы.
211! Таза еріткішпен салыстырғанда ерітіндінің айырмашылығы:
* қаныққан бу қысымы жоғарылайды.
* қайнау температурасы төмендейді.
* қаныққан бу қысымы жоғарыламайды.
* қату температурасы жоғарылайды.
* қату температурасы төмендейді.
212! «Таза еріткішке қарағанда бейэлектролит ерітіндісі бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік үлесіне тең»:
* Гиббс-Коноваловтың бірінші заңы.
* Гиббс-Коноваловтың екінші заңы.
* Вант-Гофф заңы.
* Раульдің бірінші заңы.
* Рауль заңынан шығатын салдар.
213! Қай теңдеу Вант- Гофф заңына сәйкес келеді:
* ∆Тқай=Еm2.
* ∆Тқат=Кm2.
* ∆Р/Р1=х2.
* π=CRT.
* p1=p10x1 .
214! Эбулиоскопиялық константа Е:
* еріткіш табиғатына тәуелді.
* еріген зат табиғатына тәуелді.
* еріткіш табиғатына тәуелсіз.
* еріген зат температураға тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
215!. Криоскопиялық константа К:
* еріткіш табиғатына тәуелсіз.
* еріген зат табиғатына тәуелді.
* еріткіш табиғатына тәуелсіз.
* еріген зат температурасына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
216!. Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс:
* плазмолиз.
* Гемолиз.
* судың плазмадан жасушаға өтуі.
* Эндоосмос.
* жасуша қабының жарылуы.
217!. Вена ішіне жіберілетін препарат ретінде қолданылатын дәрілік зат ерітіндісі қан плазмасымен салыстырғанда болу керек:
* изотонды.
* Гипертонды.
* Гипотонды.
* Қаныққан.
* Қанықпаған.
218!. Жоғары осмостық қысымның әсерінен жасушаның осмотикалық серпімділік күйі аталады:
* Эндоосмос.
* Плазмолиз.
* Гемолиз.
* тургор.
* Экзоосмос.
219!. Дәрілік заттардың изотондық концентрациясын есептеуге болады:
* Аррениус заңы бойынша.
* фазалардың орналасуы бойынша.
* термодинамикалық әдіс бойынша.
* Раульдің екінші заңы бойынша.
* кинетикалық әдіс бойынша.
220!. Теңіз суына шомылғанда көздің қызарып, аздаған ауру белгілерінің сезілуі байланысты:
* көз алмасынан судың осмосына.
* көз алмасының ішіне қарай судың осмосына.
* суда еріген заттардың көз алмасының ішіне қарай өтуіне.
* еріген заттардың көз алмасынан теңіз суына қарай өтуіне.
* Плазмолизге.
221! Ащы суда шомылғанда көздің кенеттен ашып, ауру белгілерінің сезілуі байланысты:
* көз алмасынан судың осмосына.
* көз алмасының ішіне қарай судың осмосына.
* суда еріген заттардың көз алмасының ішіне қарай өтуіне.
* еріген заттардың көз алмасынан теңіз суына қарай өтуіне.
* Плазмолизге.
222!. Егер 2 литр суда 2 моль фруктозаны ерітсе, судың қату температурасы қалай өзгереді? Судың криоскопиялық константасы 1.860:
* Өзгермейді.
* 1.86 есе артады.
* 1.86 есе азаяды.
* 1.86 градусқа өседі.
* 1.86 градусқа азаяды.
223!. Ерітінділері үшін изотонды коэффициенті үшке тең болатын заттарды көрсетіңіз:
* С12Н22О11.
* NaCl.
* KNO3.
* CuSO4.
* CuCl2.
224!. Ерітінділері үшін изотонды коэффициенті бірден ерекшеленетін болатын заттарды көрсетіңіз:
* Лактоза.
* Глюкоза.
* Фруктоза.
* Галактоза.
* натрий гидрокарбонаты.
225!. Буферлік ерітінді құрамында:
* күшті негіз бен оның әлсіз қышқылмен әрекеттесуінен түзілген тұзынан.
* әлсіз негіз бен оның күшті қышқылмен әрекеттесуінен түзілген тұзынан.
* күшті қышқыл және оның күшті негізбен әрекеттесуінен түзілген тұзынан.
* күшті қышқыл және оның күшті негізбен әрекеттесуінен түзілген тұзынан.
* әлсіз қышқылмен әлсіз негіз.
226! Сутектік көрсеткіш рН анықталатын формула:
* рН= lgCH .
* рН=-lgCH .
* рН=-lnCH .
* рН= lnCH .
* рН=-lnCOH-.
227!. Қышқылдық орта:
* рН>7.
* pH=0.
* pH<7.
* [H ]=10-7 моль/л.
* [H ]<10-7 моль/л.
228!. Бейтарап орта:
* рН=0.
* рН=7.
* pH<7.
* [H ]<10-7 моль/л.
* [H ]>10-7 моль/л.
229!. Концентрациясы 0,1 моль/л хлорсутек қышқылы ерітіндісі үшін рН мәні:
* 1.
* 7.
* 0,1.
* 13.
* 5.
230! Концентрациясы 0,01 моль/л және иондану дәрежесі α=0,001 болатын сірке қышқылы ерітіндісі үшін рН мәні:
* 11.
* 12.
* 2.
* 10-4.
* 4.
231!. Молярлық концентрациясы 0,01 моль/л натрий гидроксиді ерітіндісі үшін рН мәні:
* 10-2.
* 10-12.
* 7.
* 12.
* 2.
232! Молярлық концентрациясы 0,01 моль/л ж2не иондану ережесі α=0,001 болатын аммоний гидроксиді ерітіндісі үшін рН мәні:
* 9.
* 10-10.
* 2.
* 10-5.
* 5.
233! 250С температурада судың иондық көбейтіндісі:
* 7.
* 10.
* 10-7.
* 1014.
* 10-14.
234!. Қышқылдық буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:
* рН=pKklg (CkVk/CCVC).
* рН=pKk-lg (CcVc/CkVk).
* рН=14-pKo lg (CkVk/CCVC).
* рН=pKk lg (CkVk/CCVC).
* рН=pKk-lg (CkVс/CCVк).
235! Негіздік буфердің рН-н анықтауға болатын Гендерсон-Гассельбах теңдеуін көрсетіңіз:
* рН=pKklg (CоVо/CCVC).
* рН=14-pKо lg (CоVо/CсVс).
* рН=14-pKк lg (CkVk/CCVC).
* рН=pKо lg (CоVо/CCVC).
* рН=pKо-lg (CсVс/CоVо).
236!. Фосфатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
* H3PO4 Na2PO4.
* H3PO4 NaH2PO4.
* Na2HPO4 Na3PO4.
* NaH2PO4 Na2HPO4.
* H3PO4 Na2HPO4.
237! Гидрокарбонатты буферге сәйкес келетін қоспаның құрамын таңдаңыз:
* H2СO3 Na2СO3.
* Na2CO3 CO2.
* H2CO3 NaHCO3.
* H2CO3 NaOH.
* NaHCO3 NaOH.
238!. Егер рН 3-ке тең болса:
* сутек иондарының концентрациясы 0,1моль/л.
* сутек иондарының концентрациясы 0,01моль/л.
* гидроксил иондарының концентрациясы 0,001моль/л.
* pOH=4.
* pOH=11.
239!. Егер рОН=3, онда:
* гидроксил иондарының концентрациясы 0,2моль/л.
* гидроксил иондарының концентрациясы 0,1моль/л.
* сутек иондарының концентрациясы 0,001.
* рН=11.
* рН=10.
240!. Вант-Гофф заңына сәйкес берілген температурада ерітіндінің осмостық қысымы тура пропорциональды болады:
* еріткіштің мольдік үлесіне.
* еріген заттың моляльды концентрациясына.
* еріген заттың мольдік үлесіне тең.
* еріткіштің молярлы концентрациясына.
* еріген заттың молярлы концентрациясына.
241!. Белоктардың қатысуынан пайда болатын қысым аталады:
* Осмостық.
* онкотикалық.
* Гидростатикалық.
* Атмосфералық.
* Парциальды.
242! Ерітіген заттың молярлы массасын анықтау үшін мына арақатынас қолданылады:
*  Тзам = Еm2.
Тзам = Еm2.
*  Ткип = Кm2.
Ткип = Кm2.
*  S = Q/T.
S = Q/T.
*  .
.
* Г = -C/RT(d  /dC).
/dC).
243 !. і- изотондық коэффициент:
* электролиттер үшін 1-ге тең.
* бейэлектролиттер үшін 1-ден артық.
* электролиттер үшін 1-ден кем.
* бейэлектролиттер үшін 1-ге тең
* электролиттер үшін 1-ден артық.
244 !  (n-* 1 өрнегі ненің мөлшерін анықтайды:
(n-* 1 өрнегі ненің мөлшерін анықтайды:
* иондану деңгейін.
* иондану константасын.
* рН мөлшерін.
* изотониялық коэффициентін.
* иондарға ыдыраған бөлшектер санын.
245! Күшті электролиттер теориясын ұсынған:
* Дебай и Хюккель.
* Вант-Гофф.
* Аррениус.
* Гиббс.
* Цвет.
246! Булану кезінде бастапқы заттың құрамы сақталатын ерітінділер:
* гомогенді.
*гетерогенді.
*тепе – теңдік.
*қайтымды.
* азеотропты.
247! Ерітіндінің негізгі коллигативтік қасиетіне жатады:
* ерітіндінің қайнау температурасының жоғарылауы.
* ерітіндінің қату температурасының төмендеуі.
* қаныққан ерітінді бетіндегі қысымның төмендеуі.
* осмостық қысым.
* қаныққан бу қысымы.
248! Эбулиоскопиялық константа Е:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
* еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
249! Криоскопиялық константа К:
* Ерітіндінің қату температурасыныі артуы мен молялді концентрациясы сандық түрде 1 моль/кг тең.
* Ерітіндінің қату температурасыныі кемуі мен молялді концентрациясы сандық түрде 1 моль/л тең.
* еріткіш табиғатына тәуелсіз.
* еріткіш табиғатына тәуелді.
* еріткіш және еріген зат табиғатына тәуелді.
IV тарау. Химиялық кинетика.
250! H2 Cl2→2HCl реакциясы келесі механизм бойынша жүреді
Cl2→Cl Cl (баяу)
Сl H2→HCl H (жылдам)
Сl H→HCl (жылдам)
Реакция реті тең болады:
* 1.
* 2.
* 3.
* ½.
* 0.
251! M2 N2→2MN реакциясы келесі механизм бойынша жүреді
M2→M M (жылдам)
M N2→MN N (баяу)
M N→MN (жылдам)
Реакция реті тең болады:
* 1.
* 2.
* 3.
* ½.
* 0.
252! H2 Br2→2HBr реакциясы үшін тепе-теңдік тұрақтысы:
* 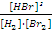 арақатынасымен анықталады.
арақатынасымен анықталады.
* 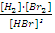 арақатынасымен анықталады.
арақатынасымен анықталады.
*  арақатынасымен анықталады.
арақатынасымен анықталады.
* Өлшемсіз.
* Өлшем бірлігі-моль*л-1.
253!. Егер жылдамдық үшін теңдеу  түрінде жазылса, онда реакция ретін анықтаңыз:
түрінде жазылса, онда реакция ретін анықтаңыз:
* 0.
* ½.
* 1.
* 1,5.
* 2.
254!. Химиялық реакцияның жылдамдық теңдеуі бойынша  оның ретін анықтаңыз:
оның ретін анықтаңыз:
* -2,5.
* 1,5.
* 1.
* -1,5.
* -1.
255! Химиялық реакцияның жылдамдық теңдеуі бойынша 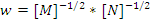 оның ретін анықтаңыз:
оның ретін анықтаңыз:
* -3,5.
* 0,25.
* 1.
* -1,5.
* -1.
256! 2А В=2С реакция үшін:
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A*CB.
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2A CB.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2С.
257! 2А В=2С реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
* W=kC2A*CB.
* W=kC2A CB.
* W=kCA*CB.
* W=kCA CB.
* W=C2A*CB.
258! 2СО О2=2СО2 реакция үшін:
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO Co2.
* Тура реакцияның кинетикалық теңдеуінің түрі W=kC2CO*Co2.
* Тура бағыттағы реакция 2 ретті.
* Тура бағыттағы реакция 3 ретті.
* Кері реакцияның кинетикалық теңдеуінің түрі W=kC2co3.
259!. 2CO O2=2CO2 реакция үшін тура реакцияның кинетикалық теңдеуінің түрі:
* W=kC2CO Co2.
* W=kC2CO*Co2.
* W=kC2co2.
* W= C2co2.
* W= kCco2.
260!. Температураны 250С-тен 45 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:
* 6 есе артады.
* 6 есе кемиді.
* 9 есе артады.
* 9 есе кемиді.
* Өзгермейді.
261!. Температураны 50 0С-ке арттырса реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=2 болса:
* 32 есе артады.
* 32 есе кемиді.
* 8 есе артады.
* 8 есе кемиді.
* Өзгермейді.
262!. Температураны 400С-ға төмендесе реакция жылдамдығы қалай өзгереді егер реакцияның температуралық коэффициенті ү=3 болса:
* 12 есе артады.
* 12 есе кемиді.
* 81 есе артады.
* 81 есе кемиді.
* Өзгермейді.
263! Егер ұсынылған стехиометриялық реакция теңдеуі 2CO O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:
* 0.
* 1.
* -3.
* 2.
* 3.
264!. Егер ұсынылған стехиометриялық реакция теңдеуі 2NO O2=2NO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:
* 0.
* 1.
* 2.
* 3.
* 4.
265!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2CO O2=2CO2 реакция жылдамдығы:
* Өзгермейді.
* 4 есе арталы.
* 8 есе артады.
* 6 есе артады.
* 8 есе кемиді.
266!. Ыдыстың көлемін 3 есе азайтса, 2CO O2=2CO2 реакция жылдамдығы:
* Өзгермейді.
* 9 есе артады.
* 9 есе кемиді.
* 27 есе артады.
* 27 есе кемиді.
267!. Реакция зонасында қысымды 3 есе арттырса, 2CO O2=2CO2 реакция жылдамдығы:
* 32 есе артады.
* 9 есе артады.
* 9 есе кемиді.
* 27 есе артады.
* 27 есе кемиді.
268!. Әрекеттесуші заттардың концентрациясын 2 есе арттырса, 2NO O2=2NO2 реакция жылдамдығы:
* Өзгермейді.
* 2 есе артады.
* 8 есе артады.
* 6 есе артады.
* 8 есе кемиді.
269!. Ыдыстың көлемін 3 есе азайтса, 2NO O2=2NO2 реакция жылдамдығы:
* Өзгермейді.
* 9 есе артады.
* 6 есе кемиді.
* 27 есе артады.
* 54 есе кемиді.
270!. Реакция зонасында қысымды 3 есе арттырса, , 2NO O2=2NO2 реакция жылдамдығы:
* 32 есе артады.
* 6 есе артады.
* 9 есе кемиді.
* 27 есе артады.
* 54 есе кемиді.
271! Әрекеттесуші заттардың концентрациясының уақыт бірлігінде өзгертетін графикалық тәуелділігі аталады:
* Беттік керілуі изотермасы.
* Кинетикалық қисық.
* Реакцияның энергетикалық профилі.
* Титрлеу қисығы.
* Адсорбсия изотермасы.
272!. Реагенттер концентрациясының химиялық реакция жылдамдығына сандық тұрғыдан әсерін сипаттайды:
* Рауль заңы.
* Гесс заңы.
* Аррениус теңдеуі.
* Вант-Гофф ережесі.
* Әрекеттесуші масалар заңы.
273!. Әрекеттесуші масалар заңының авторлары:
* Менделеев және Клапейрон.
* Клапейрон және Клаузиус.
* Гульберг және Вааге.
* Шульц және Гарди.
* Гендерсон және Гассельбах.
274! Xимиялық реакция жылдамдығының температураға тәуелділігі анықталады:
* Вант-Гофф ересімен.
* Михаэлиса- Ментен теңдеуімен.
* Аррениус теңдеуімен.
* Шульце-Гарди ережесімен.
* Әрекеттесуші масалар заңы.
275!. Ле- Шатель принципіне сәйкес Н2 І2=2НІ реакциясын тепе-тендік оңға жылжиды, егер:
* Сутектің және йодтың концентрацияларын арттырса.
* Сутектің концентрациясын азайтса.
* Иодтың концентрациясын арттырса.
* Иодтың концентрациясын азайтса.
* Иодсутектің реакция зонасын бөлі шығарса.
276!. Оттектің концентрациясын екі есе арттырса С(т) О2(т) =СО2(т) реакция жылдамдығы:
* Өзгермейді.
* 2 есе артады.
* 3 есе артады.
* 4 есе артады.
* 6 есе артады.
277!. СО концентрациясын 2 есе арттырса, 2СО О2=2СО реакция жылдамдығы:
* 2 есе артады.
* 3 есе артады.
* 6 есе кемиді.
* 4 есе артады.
* Өзгермейді.
278!. Реакция жылдамдығы тұрақтысының температураға тәуелділігін теңдеу:
* k= AEa/RT.
* k= AEaRT.
* Ink= In A – Ea/RT.
* Ink=In A - Ea RT.
* Ink=In A Ea RT.
279!. Катализатор қатысында химиялық реакцияның жылдамдығы артады:
* Ішкі энергияның азаюы арқылы.
* Энтальпияның азаюы арқылы.
* Активтендіру энергиясының азаюы арқылы.
* Энтропияның артуы арқылы.
* Активтендіру энергиясының артуы арқыл.
280! w=-dC/dt өрнегі білдіреді:
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
* бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
* екінші ретті реакция жылдамдығын.
281! w= dC/dt өрнегі білдіреді:
*реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның орташа жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын орташа жылдамдығын.
* реакция өнімнің концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*бастапқы заттар концентрациясының өзгеруі бойынша анықталатын реакцияның шын мәніндегі жылдамдығын.
*нөлінші ретті реакция жылдамдығын.
282! Химиялық реакцияның молекулалылығы:
* тек бүтін сан.
*нөлге тен болуы мүмкін.
*бөлшек сан болуы мүмкін.
*2-лен артық болмауы тиіс.
*бөлшек сан болмауы мүмкін.
283! Реакция жылдамдығының тұрақтысы тәуелді болады:
*Массаға.
*Салмаққа.
* температураға.
*Уақытқа.
*зат мөлшеріне.
284! Егер химиялық реакция жылдамдығы әрекеттесуші заттар концентрациясына тәуелсіз болса,онда реакция реті тең болады:
*3.
*½.
* 0.
*2.
*1.
285! Реакция жылдамдығының теңдеуі W=K[A]1\2 [B]-1 түрінде өрнектелсе реакцияны анықтаңыз:
* -1/2.
*2.5.
*0.
*1.
*Анықталынбайды.
286! Қандай ретті реакция үшін реакция жылдамдығы мен реакция жылдамдығының константасының өлшем бірлігі бірдей:
* нөлінші.
*Бірінші.
*Екінші.
*Үшінші.
*ондай болуы мүмкін емес.
287! Катализатор:
*кері реакция тепе-тендік куйін ығыстырады.
*реакциянын активтендіру энергиясын арттырады.
* реакциянын активтендіру энергиясын төмендетеді.
*реакциянын аяқталғанда өзгеріссіз қалады.
*тура ж/е кері реакцинын жылдамдығын бірдей дәрежеде арттырады.
288! Катализатор әсерінен химиялық реакцияда өзгереді:
*реакция өнімдерінің құрамы.
*тепе-тендік күйі.
*тепе-тендік концетрациялары.
*реакция бағыты.
* активтендіру энергиясы.
289! Нөлінші ретті реакция жылдамдығы тәуелді емес:
*Теипература.
*реагенттер табиғатына.
*катализатор қатысуына.
* реагенттер коецетрациясына.
*аталған барлық факторларға.
290! Бірінші ретті реакция жылдамдығының тұрақтысын көрсетіңіз, егер жартылай ыдырау уақыты 240с болса:
*1,44 10 -3 с -1.
* 2,88 10 -3 с -1.
*0,72-10-3 с -1.
*1,44 с -1.
*2,88 с -1.
V тарау. Химиялық кинетика.
291! Химиялық кинетика зерттейді:
* химиялық реакция жылдамдығын.
* химиялық энергияның жылулық эффектісін.
* химиялық реакциялардың өту мүмкіндігін.
* химиялық реакциялардың өту механизмін.
* реакция жылдамдығының түрлі факторларға тәуелділігін.
292! Химиялық реакция жылдамдығы үшін теңдеу w = -dC/dt жазылса, онда реакция жылдамдығы
* газ тәріздес реакция өнімі қысымы бойынша.
* газ тәріздес реакция өнімі концентрациясы бойынша.
* қатты реакция өнімі массасы бойынша.
* катализатор массасы бойынша.
* тек қана бастапқы зат концентрацияларының өзгерісі бойынша.
293! аА bB cC = mM nN реакциясы үшін тура реакциясы реті:
* 1-а.
* a b c.
* m n.
* b.
* n.
294! 2-ші ретті кинетикалық теңдеулер:
* w = kCA2
* w = kCACB
* w = k.
* w = kCA2CB
* w = kCACDCC
295! Реакцияның молекулярлығы бола алады
*кез-келген оң мәнде.
* теріс мәнде.
* нөлге тең.
* тек қана 1, 2, 3.
* бөлшек сан.
296! Келтірілген реакциялардың ішінен тримолекулярлыны таңдаңыз:
*J2 = 2J.
* CH3COCH3 = C2H4 H2 CO.
* H H M == H2 M.
* 2NO O2 = 2NO2.
* J2 H2 = 2HJ.
297! aA bB ↔ cC dD кері реакциясы үшін реттілік тең
*a b.
* a*b.
* c d.
* c*d.
* a b c d.
298! Нөлінші ретті реакция жылдамдығы анықталатын теңдеу:
* w=kC.
* w=k.
* w=kC2.
* w=kC3.
* w=kC-2.
299! Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар:
*Қарапайым.
* Қайтымды.
* Күрделі.
* ферментативті.
* Биохимиялық.
300! Бірдей зататрдың бір уақытта әрекеттесіп, бірақ түрлі өнімдер түзетін реакциялар аталады:
*Тізбекті.
* Параллельді.
* Қайтымды.
* Қосарланған.
* Кезектескен.
301! Бірінен соң бірі кезектесіп жүретін реакциялар аталады:
*Тізбекті.
* Параллельді.
* Қайтымды.
* Қосарланған.
* Кезектескен.
302! Бастапқы реакция өздігінен жүріп, екінші реакция бірінші реакцияның есебінен жүретін реакцияларды қалай атайды:
*Тізбекті.
* Параллельді.
* Қайтымды.
* Қосарланған.
* Кезектескен.
303! Бір уақытта қарама-қарсы екі бағытта жүретін реакциялардың аталуы:
*Тізбекті.
* Параллель.
* Қайтымды.
* Қосарланған.
* Кезекті.
304! «Температураны әрбір 10 градусқа көтерген сайын химиялық орташа 2-4 есе артады» Вант-Гофф ережесі қолданылмайтын реакция:
* Ферментативті.
* Бірінші ретті.
* Екінші ретті.
* Үшінші ретті.
* Фотохимиялық.
305! Өз бетінше катализатор емес, бірақ катализаторға қосқанда оның активтілігін арттыратын зат аталады:
* Промотор.
* Каталитикалық у.
* Акцептор.
* Индуктор.
* Актор.
306! Реакция жылдамдығы азаяды:
* температураны арттырғанда.
* каталитикалық удың әсерінен.
* промотор әсерінен.
* ингибитор әсерінен.
* реагент концентрациясын ұлғайтқанда.
307! Субстрат:
*ферменттің бастапқы затпен аралық комплексі.
* ферментативті реакцияның өнімі.
* ферментативті реакцияның катализаторы.
* берілген ферменттің әсер беретін қосылысы.
* ферментативті реакцияны тежейтін зат.
308! Реакцияның молекулярлығы дегеніміз:
* Реакцияның стехиометриялық коэффициенттерінің қосындысы.
* Берілген химиялық реакцияға қатысатын молекулалар саны .
* Реакцияның ретіне тең шама, егер реакция реті бүтін сан болса.
* Қарапайым бір актісіне қатысатын молекула саны.
* Анықтамалардың ешқайсысы сәйкес келмейді.
309! Бірнеше қатар кезекті стадиядан тұратын кез-келген күрделі химиялық реакцияның жылдамдығы анықталады:
*Барлық стадиялардың орташа жылдамдығымен.
* Ең жылдам стадияның жылдамдығымен.
* Ең баяу стадияның жылдамдығымен.
* Бірінші стадияның жылдамдығымен.
* Соңғы стадияның жылдамдығымен.
310! Химиялық реакцияның молекулярлығы бола алады:
*Тек бөлшек сан.
* Тек 1,2,3.
* Теріс мәнде.
* Кез-келген (бөлшек сан, бүтін сан,оң және теріс мәндерде).
* 1,2,3,4.
311! Бимолекулярлы реакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз):
*J2→2J.
* H2→2H.
* NH4Cl→NH3 HCl.
* H2 J2→ 2HJ.
* NH4CNS→ (NH*2CS.
312! Тримолекулярлыреакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз):
*CO Cl2 = COCl2.
* H2→2H.
* NH4Cl→NH3 HCl.
* Ca(HCO*2 →H2O CO2 CaO.
* 2NO O2=2NO2.
313! aA bB=mM nN тура реакциясының ретін анықтайтын теңдеуді көрсетіңіз:
*n=a*b.
* n=m*n.
* n=a b.
* n=a b m n.
* n=m n.
314! Егер реакцияның кинетикалық теңдеуі w=CAaCBbCDd түрінде жазылса, онда реакцияның жалпы реті:
* берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына.
* 1,2 немесе 3 тең.
* Анықтау мүмкін емес.
* К=a b-d формуласы бойынша табылады.
315! Тура 4NH3 5O2→4NO 6H2O реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
* w=k[NH3]4 [O2]5.
* w=k[NH3]*[O2]5.
* w=k[NH3]*[O2].
* w=k[NH3]4*5[O2].
* w=k[NH3]4*[O2]5.
316! 2NO(г) Cl2(г)→2 NOCl(г) кері реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз:
*k= [NOCl] .
[NO]2 [Cl2]
* k= [NOCl]2 .
[NO]2 [Cl2]
* k= [NOCl]2 .
[NO]2 [Cl2]
* k= 2[NOCl] .
2[NO] [Cl2]
*k= [NO] [Cl] .
[NOCl]2
317! Қысымның өзгерісі реакцияның тепе-теңдігін ығыстырмайды:
*C(к) CO2(г)=2CO(г) Q.
* 2NO(г) Cl2(г)→2NOCl(г) Q.
* 2SO2(г) O2(г)→2SO 3(г) Q.
* N2(г) O2→2NO(г) Q.
* 2NO2(г)→N2O4(ж) Q.
318! Егер жүйедегі қысымды 5 есе ұлғайса, N2(г) O2↔2NO(г) тура реакция жылдамдығы:
*5 есе артады.
* 5 есе кемиді.
* Өзгермейді.
* 25 есе артады.
* 25 есе кемиді
319! Реакцияның температуралық коэффициенті γ=3. Егер температураны 25˚С-тен 55˚С-ке өзгертсе, реакция жылдамдығы:
*27 есе кемиді.
* 27 есе артады.
* 9 есе артады.
* 9 есе кемиді.
* Өзгермейді.
320! Реакцияның температуралық коэффициенті γ=2. Егер температураны 373К-нен 323К-ге дейін өзгертсе, реакция жылдамдығы:
*10 есе артады.
* 10 есе кемиді.
* 32 есе артады.
* 32 есе кемиді.
* Өзгермейді.
321! 3 ретті реакцияның кинетикалық теңдеуін көрсетіңіз:
*w=k.
* w=kCACB2.
* w=kCA.
* w=k CB2.
* w=k CACB.
322! 1 ретті реакция үшін жартылай ыдырау уақытын анықтауға болатын өрнекті табыңыз:
* t1/2=C.
2k
* t1/2=ln2.
k
* t1/2=0.69.
k
*t1/2=1 .
kCn
*t1/2=1 3 .
k 2Cn2
323! Химиялық реакция жылдамдығының өлшем бірліктері:
*молек. *см-3*с-1.
* моль*л-1*с-1.
* молек.*см3*с-1.
* моль/л.
* моль*л-1*с1.
324! Ферментативті процестер жылдамдығын сипаттайтын теңдеу:
*Смолуховский.
* Михаэлис-Ментен.
* Аррениус.
* Вант-Гофф.
* Гиббс.
325! Реакция реті дегеніміз
* Бастапқы заттар бөлшектерінің әртүрлі сандық мөлшері
* Бастапқы заттар мен өнімдердің бөлшектерінің әртүрлі сандық мөлшері
* Бірінші элементарлық актіге қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
* Бірінші элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
* Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
326! Реакцияның молекулярлығы деп
* Бастапқы заттардың әртүрлі бөлшектерінің сандық мөлшері
* Бастапқы заттар мен өнімдердің әртүрлі бөлшектерінің сандық мөлшері
* Біріншілік элементарлық ауысу актіне қатысатын бастапқы заттардың бөлшектерінің сандық мөлшері
*Біріншілік элементарлық ауысу актіне қатысатын және өзгеретін бастапқы заттардың бөлшектерінің сандық мөлшері
*Кинетикалық теңдеудің дифференциалдық формасындағы концентрацияның дәреже көрсеткіші
327! Бір бағытты гомогенді екінші ретті реакцияның «2A =ӨНІМДЕР» түріндегі гомогендік реакциясының бірінші тәжірибедегі бастапқы заттарының жартылай айналу периоды 30 минутты құрады. Екінші тәжірибедегі сол температурада және біріншіге қарағанда А затының концетрациясы 2 есе көбейтілген болса жартылай өзгеру периодын (минутпен алғанда) табыңыз
* 11
* 12
* 13
* 14
* 15
328! Химиялық реакцияның жылдамдығының константасы
*кез келген уақыттағы реакцияның жылдамдығына тең
* егер реагенттер концентрациясы бірге тең болса, ол реакция жылдамдығына тең
* әсерлесуші заттардың концентрациясына байланысты
* әсерлесуші заттардың концентрациясына байланысты емес
* элементарлық актіге қатысатын молекула санына тең
329! Температураны 25°тан 45°С арттырғанда жылдамдық реакциясы қалай өзгереді. Егер реакцияның температура коэффициентіγ = 3 тең болса?
* 6 есе өседі
* 6 есе азаяды
* 9 есеөседі
* 9 есе азаяды
* өзгермейді
330! Температураны 50 градусқа арттырғанда реакция жылдамдығы қалай өзгереді. Егер реакцияның температура коэффициенті γ = 2 тең болса?
* 32 есеөседі
*32 есеазаяды
* 8 есеөседі
* 8 есеазаяды
* өзгермейді
331! Егер реакцияның температура коэффициенті γ = 3, онда температураны 40 градусқа азайтқанда реакция жылдамдығы ...
* 12 есеөседі
* 12 есеазаяды
* 81 есеөседі
* 81 есе азаяды
* өзгермейді
332! 2СО  =2С
=2С  реакцияның молекулярлығын анықтаңыз
реакцияның молекулярлығын анықтаңыз
* 0
* 1
* -3
* 2
* 3
333! Егер берілген реакцияның стехиометриялық теңдеуі оның механизміне жауап берсе, онда оның молекулярлық реакциясы 2NO  = 2N
= 2N  тең
тең
* 0
* 1
* 2
* 3
* 4
334! Әсерлесуші заттардың концентрациясының уақыт бойындағы графикалық тәуелділігінің өзгерісі аталады
* беттік керілу изотермасы
* кинетикалық қисық
* реакцияның энергетикалық профилі
* қисық
* адсорбция изотермасы
335! химиялық реакция жылдамдығына реагенттер концентрациясының әсерін сандық сипаттайтын
* Рауль заңы
* Гесс заңы
* Аррениус теңдеуі
* Вант-Гофф ережесі
* әрекеттесуші массалар заңы
336!. әрекеттесуші массалар заңының авторлары кім:
* Гульдберг и Вааге
*Клапейрони Клаузиус
* Менделеев и Клапейрон
* Шульц и Гарди
* Гендерсон и Гассельбах
337! Химиялық реакцияның жылдамдығының температураға тәуелділігі мына теңдеумен бейнеленеді :
* Гесстің
* Михаэлис-Ментеннің
* Аррениустың
* Шульце-Гарди ережесімен
* әрекеттесуші массалар заңы
338! Ле-Шателье принципі бойынша H2 J2→2HJ реакцияның тепе-теңдігі оңға қарай ығысады, егер
* Йод пен сутектің концентрациясын көбейтсе
* Сутектің концентрациясын азайтса
* йодсутектің концентрациясын көбейтсе
* Йодтың концентрациясын азайтса
* H2 және I2 концентрациясын азайтса
339!. СО концентрациясын 2есе арттырса, реакция жылдамдығы 2СО О2 = 2С02 қандай:
* 4есе артады
* 3есе артады
* 6есе артады
* 2 есе артады
* өзгермейді
340! Катализатор химиялық реакцияның жылдамдығын ...... арқылы көбейтеді
* ішкі энергияның төмендеуі
* энтальпияның төмендеуі
* активтілік энергиясының төмендеуі
* энтропияның артуы
* активтілік энергиясының артуы
341! w = dC/dt нені білдіреді:
* Реакция өнімінің концентрациясының өзгеруіне байланысты реакция жылдамдығы
* бастапқы заттың концентрациясының өзгеруіне байланысты реакция жылдамдығы
*Реакция өнімінің концентрациясының өзгеруіне байланысты реакцияның шынайы жылдамдығы
* бастапқы заттың концентрациясының өзгеруіне байланысты реакцияның шынайы жылдамдығы
* екінші ретті реакция жылдамдығы
342! w = dC/dt білдіреді:
* Реакция өнімінің концентрациясының өзгеруіне байланысты реакцияның шынайы жылдамдығы
* Реакция өнімінің концентрациясының өзгеруіне байланысты реакция жылдамдығы
* бастапқы заттың концентрациясының өзгеруіне байланысты реакция жылдамдығы
* бастапқы заттың концентрациясының өзгеруіне байланысты реакцияның шынайы жылдамдығы
* екінші ретті реакция жылдамдығы
343! Химиялық реакцияның молекулярлығы қандай болады:
* әрқашан бүтін сан
* 0-ге тең болуы мүмкін
* бөлшек сан болуы мүмкін
* 2-ден үлкен бола алмайды
* бөлшек сан болмайды
344! Реакция жылдамдығының константасы байланысты:
* массаға
* уақытқа
* заттың мөлшеріне
* салмағына
* температураға
345! Егер химиялық реакцияның жылдамдығы реакцияға қатысушы заттың концентрациясына тәуелді болмаса, онда реакцияның реті тең:
* 3
*1/2
* 0
* 2
* -1/2
346! Катализатор - бұл
* қайтымды реакцияның тепе-теңдік күйін бұзады
* реакцияның активтілік энергиясын арттырады
* реакция аяғында өнім береді
*Тура реакцияның жылдамдығын арттырады
* реакцияның активтілік энергиясын төмендетеді
347! Химиялық реакцияға катализатор қосқанда, не өзгереді?
* активтілік энергиясы
* реакция өнімдерінің құрамы
* тепе-теңдік концентрациялар
* тепе-теңдік күйі
* реакция бағыты
348! Нөлінші ретті реакцияның жылдамдығы тәуелсіз:
* температураға
* реагенттердің табиғатына
* катализаторлар қатысына
* реагенттердің концентрациясына
* жоғарыдағылардың барлығына
349! Изотермиялық кеңейу кезінде 3 моль идеал газ көлемі 10 есе көбейді. Газ энтропиясының өзгеруін мына формуламен анықтауға болады: n·R, R – универсал газ тұрақтысы.n санын анықтаңыз (ең жуық бүтін мәнге дейін).
* 2
* 4
* 5
* 7
* 8
350! 300 ден 600 К дейінгі изобаралық қыздыру кезіндегі гелийдің(2 моль біратомды газ) энтропия өзгерісін анықтаңыз.Газ идеал болып саналады.Жауабын Дж/К деп есептеп ең жуық бүтін мәнін анықтаңыз.
* 13
* 29
* 35
* 57
* 64
351! Изотермиялық ығысу кезінде 3 моль идеалгаз қысымы Т температурада 10 есекөбейді. Газдың Гиббс энергиясының өзгеруін мына формуламен анықтауға болады:n·RТ, R – универсал газ тұрақтысы.n санын анықтаңыз (ең жуық бүтін мәнге дейін).
* 2
* 4
* 5
* 7
* 9
352! Жабық термодинамикалық жүйені тап
*адам
* өсімдік
* суып келе жатқан тас
* әлем
* Клетка
353! Термодинамикалық жүйені өлшеуге болатын параметрлер қалай аталады
*интенсивтік
* экстенсивтік
* Негізгі
* Тепе теңдік
*күй функциясы
354! Термодинамикалық жүйені өлшеуге болмайтын параметрлер қалай аталады
* күй функциясы
*интенсивті
* экстенсивті
* Тепе теңдік
* негізгі
355! Адам қандай термодинамикалық жүйеге жатады
*Гомогенді
* Монофазалық
* жабық
* оқшауланған
* гетерогенді, ашық
356! Джоульмен өлшенетін физикалық шаманы таңдаңыз:
*көлем
* температура
* Жылу мөлшері
* Жылу сыйымдылық
* Энтропия
357! Химиялық реакция жылдамдығы дегеніміз :
* әрекеттесетін заттың біреуінің концентрациясының уақыт бірлігіне байланысты өзгеруі
*бүтін өнімнің уақыт бірлігіндегі шығымы
*бастапқы заттың уақыт бірлігіндегі өзгеру дәрежесі
*заттың жартылай өзгеру уақыты
*дұрыс жауабы жоқ
358! Реакцияның кинетикалық өзгеруі дегеніміз не? Реакция жылдамдығының теңдігі неге тәуелді:
* концентрацияға
*температураға
*катализатор санына
*қысымна
*aуа қысымына
359! Температураның өсуімен қандай реакциялардың жылдамдығы артады?
*энергия бөле жүретін реакция
* энергия сіңіре жүретін реакция
*кез-келген
*тура бағытта жүретін реакция
*температураға
360! Реакцияның молекулярлығы дегеніміз не ? Реакцияның молекулярлығы деп:
*кинетикалық теңдеуде концентрацияның дәреже көрсеткішінің суммасын
*реакцияға қатысатын реакция компонентінің санын
* химиялық әрекеттесудің элементарлық актіна қатысатын молекулалардың санын
*химиялық әрекеттесу кезінде түзілетін молекулалардың санын
*реакцияға қатысатын иондардың саны
361! Реакцияның реті және молекулярлық қай жағдайда сәйкес келеді?
* қарапайым
*бірге жүретін
*параллель
*жүйелі
*ешқашан
362! Мына теңдік  қай жылдамдық константасы болып келеді:
қай жылдамдық константасы болып келеді:
*2 реттік қайтымсыз реакцияның
* 1 реттік қайтымсыз реакцияның
*1 реттік қайтымды реакциянаң
*жүйелі екінші реттік реакция
*3 реттік қайтымсыз реакцияның
363! Активтену энергиясы дегеніміз не?
*әсер ететін заттың активтену энергиясы
* орташа энергияға қарағанда артық энергиядағы молекуланың соқтығысуы химиялық реакцияға әкеліп соқтырады
*химиялық реакцияның актін қамтамасыздандыратын молекулалардың энергиясы
*химиялық реакцияның соқтығысуына әкелетін молекулалардың минималды энергиясы
*реакцияға әсер етпейтін заттың активтену энергиясы
364! Химиялық реакцияға түсетін кейбір артық энергияның мөлшері (орташа мөлшерге қарағанда) қалай аталады?
*потенциалды
*кинетикалық
* активтену энергиясы
*энергияның кванттық ауысуы
*механикалық
365! Реакциялық жылдамдықтың температурадан тәуелділігін білгенде қандай информация алуға болады?
*реакция жылдамдығын және активтену энергиясын есептеуге болады
* активтену энергиясын және экспоненциал алдыңғы көбейткішті анықтауға болады
*реакцияның механизмін анықтауға және активтену энергиясын есептеуге болады
*реакцияның экспоненциал алдыңғы көбейткішін есептеуге болады
*бұл тәуелділіктен ешқандай информация алуға болмайды
366! Аррениустың дұрыс өрнегін көрсетіңіз:
* 
* 
* 
* 
*- 
367! Көзге көрінетін, жарыққа жақын, толқын ұзындығының сәулелену әсерімен жүретін реакция қалай аталады?
*тізбектік
* фотохимиялық
*бірге жүретін
*гетерогенді
*гомогенді
368! А → В→ С реакциясы қайсысына жатады?
*тізбектік
* жүйелік
*параллельдік
*фотохимиялық
*гетерогенді
369! Алдыңғы зат радикал қатысымен жүйелі кезектесіп жүретін реакция арқылы өнімге айналатын процесс қалай аталады?
* тізбектік
*бірге жүретін
*жүйелік
*параллельдік
*күрделі