 |
|
Номенклатурасы, стереоизомериясы. 7 страница
2. Хроматографиялық талдау әдісінің негіздері. Хроматографиялық әдістердің жіктелуі. Биология мен медицинада қолданылуы.
3. Дисперсті жүйелер: негізгі түсініктер, жіктелуі, қасиеттері.
4. Коллоидты ерітінділерді алу және тазарту әдістері. Мицелла құрылысы. Диализдің медицинада қолданылуы.
ОҚЫТУ әдістері:
Үйлескен түрде:
- материалды мәселелік түрде баяндау;
- кіші топтарда жұмыс жасау (лабораториялық жұмысты орындау);
САБАҚТЫҢ ХРОНОМЕТРАЖЫНА МЫСАЛ
| Кіріспе бөлім (ұйымдастыру кезеңі) | 5 мин | |
| Тақырып бойынша семинар және пікірталас | 20 мин | |
| Лабораториялық жұмысты теориялық тұрғыдан талқылау | 25 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмысты орындау | 35 мин | |
| Мицелланың құрылысын талқылау | 15 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмыстың нәтижелерін есептеу және қорғау | 25 мин | |
| Тақырып бойынша бақылау | 20 мин | |
| Сабақты қорытындылау | 5 мин |
БАҚЫЛАУ:
Бағаланатын құзыреттіліктер
1) Білім.
Бақылау әдістері:
1. Тест тапсырмаларын орындау немесе билет бойынша бақылау
2. Лаболраториялық жұмыс нәтижелерінің безендірілуін тексеру
Бақылау сұрақтары
1. Ионалмасу адсорбция және оның қолдану мүмкіндігін сипаттаңыз.
2. Хроматографиялық әдістер және олардың жіктелуі. Адсорбциялық және таралу хроматография әдістеріі неге негізделген? Иондардың адсорбциялануға қабілеттілігі мен олардың заряды бір-бірімен қалай байланысты болады?
3. Хроматографиялық әдістердің медициналық-биологиялық зерттеулерде және санитарлық-гигиеналық мақсатта қолданылуына сипаттама беріңіз.
4. Дисперстілік дәрежесі, фазалардың агрегаттық күйі, дисперсті фаза мен дисперсті ортаның өзара әрекеттесу сипатына қарай дисперсті жүйелердің жіктелуін сипаттаңыз. Мысалдар келтіріңіз.
5. Коллоидты жүйелер деп жүйенің қандай түрін айтады? Коллоидты ерітінділердің молекулалық-кинетикалық және оптикалық қасиеттерін дөрекі дисперсті жүйелер мен шынайы ерітінділердің қасиеттерімен салыстырып қараңыз. Тиндаль конусы деген не?
6. Коллоидты жүйелердің диспергациялық және конденсациялық алу әдістерінің мәні неде? Пептизация деген не?
7. Мицелланың құрылысы. ҚЭҚ, электротермодинамикалық потенциал, электрокинетикалық потенциал.
Әдебиет:
Негізгі:
1. Сейтембетов Т.С. Химия.- Алматы, 1994.- 23-37 б.
2. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.- М., 2001.-101-131 б.
3. Ленский А.С.Введение в бионеорганическую и биофизическую химию.- М.: ВШ, 1989.- 55-92 б.
4. Веренцова Л.Г., Нечепуренко Е.В., Батырбаева А.Ә., Карлова Э.К. Бейорганикалық, физикалық және коллоидты химия: оқу құралы -29-47 б.
5. Есімжан А.Е. Жалпы химия практикумы- Алматы, 2004.- 102-120 б.
6. Рубина Х.М. и др. Практикум по физической и коллоидной химии. – М., 2001. – 71-89 б.
Қосымша:
1. Ершов Ю.А. и др. Общая химия. Биофизическая химия. Химия биогенных элементов.- М.: ВШ, 2003.- 391-422 б.
2. Слесарев В.И. Химия. Основы химии живого. - СПб.: Химиздат, 2001.- 96-123 б.
3. Ленский А.С., Белавин И.Ю., Быликин С.Ю. Биофизическая и бионеорганическая химия: медициналық ЖОО-на арналған оқу құралы.- М.:ООО «медицинское информационное агентство», 2008.- 174-178, 182-207 б.
4. Зеленин К.Н., Алексеев В.В. Химия.- С.-Пб.: ЭЛБИ-СПб, 2003.- 107-124 б.
5. Попков В.А., Пузаков С.А. Общая химия: құрал.- М.: ГЭОТАР-Медия, 2009.- 200-239 б.
6. Евстратова К.И. и др. Физическая и коллоидная химия. – М.: ВШ, 1990. - 260-302 б.
7. Бірімжанов Б.А. Жалпы химия: ЖОО-на арналған оқу құралы– Алматы.:Білім, 2001.
ҚОСЫМША:
Лабораториялық жұмыс
«МЫС(ІІ) ЖӘНЕ ТЕМІР(ІІІ) ИОНДАРЫН БІР-БІРІНЕН БАҒАНАЛЫҚ ХРОМАТОГРАФИЯ ӘДІСІМЕН БӨЛУЖӘНЕ ТАҒАМ ӨНІМДЕРІНДЕГІ ТЕМІР(ІІІ) ИОНЫН ҚАҒАЗДЫҚ ХРОМАТОГРАФИЯ ӘДІСІМЕН АНЫҚТАУ»
Жұмыстың мақсаты:
Мыс(ІІ) және темір(ІІІ) иондарын бір-бірінен бағаналық және қағаздық хроматография әдістерімен бөлу. Тағам өнімдеріндегі темір(ІІІ) ионын анықтау.
Жұмыстың орындалу тәртібі:
1 тәжірибе. Мыс (ІІ) және темір (ІІІ) иондарын бір-бірінен бағаналық хроматография әдісімен бөлу
Диаметрі 1 см шыны түтіктен хроматографиялық бағана дайындайды: түтіктің төменгі жағына мақта қабатын (0,5 см) орналастырады, оның жоғарғы жағынан биіктігін 2,5-3 см етіп алюминий оксидін салады. Дайын болған бағананы штативте тұрған сынауыққа орналастырады.
Таза сынауыққа қоспа дайындайды: 1,5 мл 0,05 % CuSO4 ерітіндісі және 1,5 мл 0,05 % FeCl3 ерітіндісі. Осы қоспаны хроматографиялық бағанаға құяды. Тамшылау жылдамдығы онша тез емес. Қоспадағы компоненттер жеке аумақтаға бөлінгеннен кейін, бағана арқылы 3 мл 1 % калийдің гексацианоферратын(ІІ) жіберіп айқындау жүргізеді. Fe3+ иондары бар аумақ қарқынды көк түске боялады, ал Cu2+ иондары бар аумақ қоңыр түске боялады.
Реакция теңдеулері:
4FeCl3 + 3K4[Fe(CN)6] ® Fe4[Fe(CN)6]3¯ + 12KCl
2CuSO4 + K4[Fe(CN)6] ® Cu2[Fe(CN)6]¯ + 2K2SO4
Қорытынды: Мыс(ІІ) және темір(ІІІ) иондарын бір-бірінен бағаналық хроматография әдісімен бөлу мүмкіндігін бағалаңыз.
2 тәжірибе. Тағам өнімдеріндегі темір(ІІІ) ионын қағаздық хроматография әдісімен анықтау
Хроматографиялық қағаздан ені 6 см және ұзындығы 10 см жолақ қиып алады. төменгі шетінен 1 см қашықтықта қарындашпен жіңішке етіп сызық жүргізеді (старт сызығы). Жіңішке капилляр көмегімен старт сызығына зерттелетін ерітінді дақтың диаметрі 5 мм-ден аспайтындай етіп тамызады. Осы старт сызығына дақтан 2-3 см қашықтықта басқа капиллярмен 0,05 % темір(ІІІ) хлориді ерітіндісін тамызады. Қағазды ауада кептіреді. Осылай дайындалған хроматографиялық қағаз жолағын, шеттері резина көмегімен ұстатылған екі таяқшаға бекітеді және еріткіштер қоспасы бар (этанол және сұйылтылған тұз қышқылы, 1:4) стақанға салады. Стақандағы еріткіштер қабатының қалыңдығы 1-1,5 см тең болуы тиіс. Қағаз жолағы сұйықтыққа 2-3 мм батырылып орналастырылуы тиіс. еріткіштер 7-8 см биіктікке көтерілгенде, жолақты стаканнан шығарады және карандашпен еріткіш көтерілген биіктікті белгілейді. Хроматографиялық қағазды ауада кептіреді. Темір(ІІІ) ионын анықтау үшін жолақты калийдің гексацианоферратымен(ІІ) дымқылдайды.
Қорытынды:Хроматограмманы салыңыз. Стандартты ерітінді мен зерттелетін ерітіндінің пішінін, түсін және старт сызығынан басталған ара қашықтығын салыстыра отырып, иондардың идентификациясы туралы қорытынды жасаңыз, темір(ІІІ) ионы бойынша ерітінділердің концентрацияларын салыстырыңыз.
ҚОСЫМША
Көрнекілікті эксперимент
«КОЛЛОИДТЫ ЕРІТІНДІЛЕРДІ АЛУ ЖӘНЕ ОЛАРДЫҢ ҚАСИЕТТЕРІН ЗЕРТТЕУ»
Жұмыстың мақсаты: Коллоидты ерітінділерді алудыңжәне тазартуәдістемелерін меңгеру; коллоидты бөлшектердің зарядын және коагуляция табалдырығын анықтауды үйрену
1 тәжірибе.«Гидролиз реакциясымен темір(ІІІ) гидроксиді золін алу»
FeCl3+3Н2О→Fe(ОН)3+3НCl
Fe(ОН)3+3НCl→FeОCl+2Н2О
FeОCl-стабилизатор
FeОCl→ FeО++Cl-
Жұмыстың орындалу тәртібі:Сынауықтың жартысына дейін дистилденген су құяды және қайнағанша қыздырады. Осы қайнап тұрған суға 2-3 тамшы 2 % темір(ІІІ) хлориді ерітіндісін қосады және қызыл-қоңыр бояу пайда болғанша қайта қыздырады. Тиндаль конусын байқау арқылы коллоидты ерітіндінің түзілгеніне көз жеткізеді.
Қорытынды: Алынған темір(ІІІ) гидроксиді золі мицелласының формуласын жазыңыз және оны алу әдісін көрсетіңіз.
2 тәжірибе.«Тотықсыздану реакциясымен күміс золін алу»
AgNO3+K2CO3→AgOK+KNO3+CО2↑
6AgOK+C76H52O46+3Н2О→6Ag+C76H52O49+6KOH
таннин флобафен
AgOK-стабилизатор
AgOK → AgО-+K+
Жұмыстың орындалу тәртібі:Сынауықтың жартысына дейін дистилденген су құяды, 1 мл 0,01М күміс нитраты мен 3-4 тамшы 0,1 % таннин ерітіндісін қосады. Содан кейін араластыра отырып қызылдау-қоңыр бояу алынғанша 1 % калий карбонатын қосады. Таннин мөлшері аз болғанда күміс золі қызыл сары-сары түске боялады. Тиндаль конусын байқау арқылы коллоидты ерітіндінің түзілгеніне көз жеткізеді.
Қорытынды: Алынған күміс золі мицелласының формуласын жазыңыз және оны алу әдісін көрсетіңіз.
3 тәжірибе.«Берлин көгі золін алу»
4FeCl3+3K4[Fe(CN)6]→Fe4[Fe(CN)6]3↓+12KCl
Жұмыстың орындалу тәртібі:Екі сынауық алады. Бірінші сынауыққа 5 мл 0,05 % калийдің гексацианоферраты(ІІ) ерітіндісін құяды, пәрменді араластыра отырып, 3 тамшы 1 % темір(ІІІ) хлориді ерітіндісін қосады. Қою көк түске боялған золь түзіледі.
Екінші сынауыққа 5 мл темір(ІІІ) хлориді ерітіндісін құяды, пәрменді араластыра отырып, 3 тамшы калийдің гексацианоферраты(ІІ) ерітіндісін қосады. Жасыл түске боялған золь түзіледі. Тиндаль конусын байқау арқылы екі сынауықта да коллоидты ерітіндінің түзілгеніне көз жеткізуге болады.
Қорытынды: Алынған көк және жасыл түсті берлин көгі золі мицеллаларының формуласын жазыңыз, стабилизаторды көрсетіңіз және олардың алыну әдістерін атаңыз.
4 тәжірибе.«Канифоль золін алу»
Жұмыстың орындалу тәртібі:
Сынауыққа 5 мл дистилденген су құяды және 2 тамшы 2 % канифольдің спирттегі ерітіндісін қосады, сілкиді. Тиндаль конусын байқау арқылы коллоидты ерітіндінің түзілгеніне көз жеткізуге болады.
Қорытынды: Әдістің маңызын сипаттаңыз.
5 тәжірибе.«Темір(ІІІ) гидроксиді тұнбасын пептизациялау»
FeCl3 +3 NH4OH ® Fe (OH)3¯+3 NH4CI .
Жұмыстың орындалу тәртібі:
Сынауыққа 5 мл 2 % темір(ІІІ) хлориді ерітіндісін құяды, аздаған бөліктермен тұнба түзілгенше 10 % аммоний гидроксиді ерітіндісін қосады. Алынған тұнбаны артық электролиттер толық жойылғанша, дистилденген сумен декантациялап жуады. Жуылған тұнбаға 15 мл дистилденген су қосады, араластырады және үш сынауыққа бірдей етіп бөледі. Бірінші сынауыққа пептизатор болып табылатын - 2 мл қаныққан темір(ІІІ) хлориді ерітіндісін қосады, екіншісіне - 2 мл 0,1М хлорсутек қышқылын қосады, ол Fe(ОН)3 әрекеттесіп, стабилизатор FeОCl түзеді, ал үшіншісіне – 2 мл дистилденген су қосады (бақылау тәжірибесі).
Ерітінділерді араластырады және 10 мин қалдырады. Белгіленген уақыт өткеннен кейін, байқалған өзгерістерді кестеге жазады.
| № | Сынауық ішінде, мл | Қосылған электролит | Пептизация түрі | Мицелла формуласы |
| FeCl3 | ||||
| НCl | ||||
| Н2О (бақылау) |
Қорытынды: Түзілген зольдер мицеллаларының формуласын жазыңыз; пептизация типін көрсетіңіз, пептизация әдісінің маңызын сипаттаңыз.
6 тәжірибе. «Диализ әдісімен темір(ІІІ) гидроксиді золін тазалау»
Мақсаты: Диализ әдісін меңгеру.
Жұмыстың орындалу тәртібі:
Жартылай өткізгіш мембрана ретінде коллолийлі қапшыққа 3 мл жаңа дайындалған темір(ІІІ) гидроксиді золін құяды және оны дистилденген суы бар стаканға салып қояды. 15 мин өткен соң стакандағы судан сынама алады және онда хлорид-иондарының бар екенін бірнеше тамшы күміс нитраты ерітіндісін тамызу арқылы анықтайды. Салыстыру үшін екінші сынауыққа дистилденген судан алып, оған 1-2 тамшы АgNО3 ерітіндісін тамызады.
Қорытынды: Диализ әдісінің маңызын түсіндіріңіз.
7 тәжірибе. «Коллоидты ерітінділерде жарық бергіш қондырғының көмегімен Тиндаль конусын бақылау»
Жұмыстың орындалу тәртібі:
Жарықтандырғыш қондырғы – ішкі жағы қара түске боялған және қабырғасында диаметрі шамамен 1 см болатын тесігі бар камера. Камераға күшті жарықтың көзі орналастырылған (қуаттылығы жоғары электрлік лампа). Коллоидты ерітіндісі бар кюветаны сәуле шоғырының жолына қояды. Дәл осындай тәжірибені шын ерітіндімен қайталайды.
Қорытынды: Көрген құбылыстарды сипаттаңыз. Себебін түсіндіріңіз.
8 тәжірибе. «Капиллярлық талдау әдісімен боялған зольдердегі коллоидты бөлшектердің заряд таңбасын анықтау»
Мақсаты: Боялған зольдердіңі заряд таңбасын анықтау.
Әдістің маңызы:Сүзгі қағазы капиллярының қабырғалары суда сутек ионын бөліп шығарып, теріс зарядталады.
Оң зарядталған коллоидты бөлшектер капилляр қабырғаларында адсорбцияланады, ал су олар арқылы оңай өтіп кетеді. Нәтижесінде сүзгі қағазында үлкенірек түссіз су аумағы бар кішірек боялған дақ пайда болады.
Зольдердің теріс зарядталған коллоидты бөлшектері капилляр қабырғаларынан тебіледі, нәтижесінде сүзгі қағазында кішірек түссіз су аумағы бар үлкен боялған дақ пайда болады.
Жұмыстың орындалу тәртібі:
Сүзгі қағазына қашықтығы 1-2 см болатындай етіп, бір тамшыдан темір(ІІІ) гидроксиді, берлин көгі зольдерін және 2 % бояғыш ерітінділері: эозин, флуоресцеин, метилен көгін тамызады. Пайда болған боялған дақтардың сипатына қарай, олардың заряд таңбасын анықтау керек.
Қорытынды: Зерттелген зольдердің заряд таңбасын көрсетіңіз.
9 тәжірибе.«Темір(ІІІ) гидроксиді золінің коагуляция табалдырығын анықтау»
Мақсаты:
Темір(ІІІ) гидроксиді золінің коагуляциясына әртүрлі электролиттердің әсерін қарастыру, тәжірибелік мәліметтер бойынша олардың коагуляция табалдырығын есептеу.
Жұмыстың орындалу тәртібі:
Екі сынауыққа 1 мл-ден гидролиз реакциясымен алынған темір(ІІІ) гидроксиді золін құяды, бірінші сынауыққа тамшылата отырып, жайлап және араластыра отырып, зольдің бүкіл көлемінде лайлану пайда болғанша калий сульфаты ерітіндісін қосады. Екінші сынауыққа ұқсас түрде золь лайланғанша калийдің гексацианоферраты(ІІІ) ерітіндісін қосады. Тәжірибе нәтижелерін кестеге жазады.
Тәжірибенің нәтижелері:
Концентрация С(K2SO4)=0,1 моль/л
Концентрация С(K3[Fe(CN)6])=0,1 моль/л
Көлем 1 тамшы = 0,05 мл
| Электролит | Золь көлеміVзоль, мл | Электролит тамшысының саны | Электролит көлеміVэл, мл | Коагуляция табалдырығыСk, ммоль/л | Электролиттің коагуляциялау қабілетіVк, л/ммоль |
| K2SO4 | |||||
| K3[Fe(CN)6] |
Есептеңіз:
· электролиттер үшін коагуляция табалдырығын
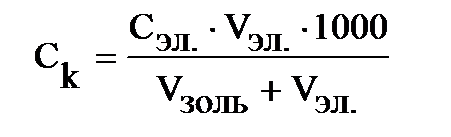

· электролиттердің коагуляциялау қабілетін

Темір(ІІІ) гидроксиді золі мицелласының формуласын жазыңыз.
Қорытынды: Электролиттер үшін коагуляция табалдырығын көрсетіңіз, ион-коагулянттардың коагуляциялау қабілеттеріндегі айырмашылықты түсіндіріңіз.
№5 тәжірибелік сабақ
Тақырыбы:Тотығу-тотықсыздану процестері. Асқазан сөлін потенциометрлік титрлеу
Мақсаттары:
· гальваникалық элементтердің құрылысы мен жұмыс істеу принципі туралы түсініктерді қалыптастыру;
· әр түрлі электродтардың электродты потенциалын есептей білуді және гальваникалық элементтердің ЭҚК-н анықтай білуді үйрету;
· ағзадағы патологиялық өзгерістердің мәнін түсінуге мүмкіндік беретін рН пен басқа физикалық-химиялық параметрлерді анықтау үшін қолданылатын электрохимиялық әдістерді қарастыру арқылы студенттерде химияны зерттеу мотивациясын дамыта білу;
· ақпаратпен өздігінен жұмыс істеу дағдыларын жетілдіру.
ОҚыту міндеттері:
· I және II текті, тотығу-тотықсыздану электродты потенциалдардың құрылысы және олардың жұмыс істеу принципі жайлы түсініктерін кеңейту;
· биологиялық сұйықтықтардың рН-н анықтауда потенциометрлік титрлеуді пайдалану мүмкіндігін көрсету;
· ерітіндідегі сутек иондарының концентрациясын есептеу үшін интегралды және дифференциалды қисықтарды тұрғызу туралы ақпарат беру;
· электродты потенциалдарды есептеу үшін Нернст және Нернст-Петерс теңдеулерін қолдануды үйрету;
· электрохимиялық жүйелердің ЭҰК-н есептеу дағдыларын қалыптастыру;
Тақырыптың негізгі сұрақтары:
1. Электрод. Электродты потенциал. Тотығу-тотықсыздану электродты потенциалдары. Нернст теңдеуі.
2. Электродтардың жіктелуі: I және II текті электродтар, редокс-электродтар, ионселективті электродтар. Анықтауыш және салыстырушы электродтары. Хлоркүміс электроды – медициналық-биологиялық зерттеулерде қолданылатын салыстырушы электроды.
3. Гальваникалық элемент. Гальваникалық элементтің электр қозғаушы күші.
4. Диффузиялық және мембраналық потенциалдар: пайда болу механизмі, биологиялық рөлі.
5. Потенциометрлік титрлеу. Медициналық-биологиялық зерттеулерде қолданылуы.
Оқыту әдістері:
Үйлескен түрде:
- семинар;
- кіші топтарда жұмыс жасау (лабораториялық жұмысты орындау).
Сабақтың хронометражы
| Кіріспе бөлім (ұйымдастыру кезеңі) | 5 мин | |
| Тақырып бойынша семинар және пікірталас | 30 мин | |
| Нернст теңдеуі бойынша потенциалдарды есептеу | 15 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмысты теориялық тұрғыдан талқылау | 25 мин | |
| Лабораториялық жұмысты орындау | 25 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмыс нәтижелерін есептеп, қисықтар тұрғызу | 25 мин | |
| Тақырып бойынша бақылау | 20 мин | |
| Сабақты қорытындалау | 5 мин |
БАҚЫЛАУ
Бағаланатын құзыреттілік:
2) Білім.
Бақылау әдісі:
1. Тесттік тапсырмалар орындау немесе билет бойынша тексеру
Бақылау сұрақтары
1. Бірінші текті электродтар: құрылысы, потенциалын есептеу теңдеулері, мысалдар.
2. Сутек электроды. Стандартты сутек электроды.
3. Екінші текті электродтар: құрылысы, потенциалын есептеу теңдеулері, мысалдар.
4. Тотығу-тотықсыздану электродтары: құрылысы, потенциалын есептеу теңдеулері, мысалдар.
5. Гальваникалық элементтер. Гальваникалық элементтерде жүретін реакциялар, ЭҚК-н есептеу. Якоби - Даниэль элементі
6. Потенциометрлік титрлеу. Биологиялық сұйықтықтардың рН-н анықтауда анықтаушы және салыстырушы электродтар ретінде қолданылатын шыны және хлоркүміс электродтары.
7. Ағзадағы биохимиялық процестердің мысалында тотығу-тотықсыздану процестерінің жүру бағытын анықтау. Тотығу-тотықсыздану процестерінің биологиялық мәні неде?
8. Биохимиялық тотығу-тотықсыздану процестерінің басым көпшілігі қандай жағдайларда жүреді? Ағзада жүретін ТТР-ды қарастырғанда неліктен стандартты электродтық потенциалдың орнына «мидпойнт» потенциалы деген ұғымды пайдаланады?
9. Тотықтырғыштардың бактерицидті құрал ретінде қолданылуы неге негізделген?
Әдебиет:
Негізгі:
1. Сейтембетов Т.С. Химия.- Алматы, 1994.- 23-37 б.
2. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.- М., 2001.-101-131 б.
3. Ленский А.С.Введение в бионеорганическую и биофизическую химию.- М.: ВШ, 1989.- 55-92 б.
4. Веренцова Л.Г., Нечепуренко Е.В., Батырбаева А.Ә., Карлова Э.К. Бейорганикалық, физикалық және коллоидты химия: оқу құралы -29-47 б.
5. Есімжан А.Е. Жалпы химия практикумы- Алматы, 2004.- 102-120 б.
6. Рубина Х.М. и др. Практикум по физической и коллоидной химии. – М., 2001. – 71-89 б.
Қосымша:
1. Ершов Ю.А. и др. Общая химия. Биофизическая химия. Химия биогенных элементов.- М.: ВШ, 2003.- 391-422 б.
2. Слесарев В.И. Химия. Основы химии живого. - СПб.: Химиздат, 2001.- 96-123 б.
3. Ленский А.С., Белавин И.Ю., Быликин С.Ю. Биофизическая и бионеорганическая химия: медициналық ЖОО-на арналған оқу құралы.- М.:ООО «медицинское информационное агентство», 2008.- 174-178, 182-207 б.
4. Зеленин К.Н., Алексеев В.В. Химия.- С.-Пб.: ЭЛБИ-СПб, 2003.- 107-124 б.
5. Попков В.А., Пузаков С.А. Общая химия: құрал.- М.: ГЭОТАР-Медия, 2009.- 200-239 б.
6. Евстратова К.И. и др. Физическая и коллоидная химия. – М.: ВШ, 1990. - 260-302 б.
7. Бірімжанов Б.А. Жалпы химия: ЖОО-на арналған оқу құралы– Алматы.:Білім, 2001.
ҚОСЫМША
Лабораториялық жұмыс
«Асқазан сөлін натрий гидроксидінің стандартты ерітіндісімен потенциометрлік титрлеу»