 |
|
Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующую с ионным проводником (электролитом).
Методическое указание
По физической химии
«Обратимые электроды и электролиз»
Астрахань 2007
АВТОРЫ:кандидат химических наук, доцент кафедры органической, биологической и физколлоидной химии Стороженко Валентина Николаевна; кандидат химических наук, доцент кафедры органической, биологической и физколлоидной химии Летичевская Наталья Николаевна; кандидат химических наук, доцент кафедры органической, биологической и физколлоидной химии Шинкарь Елена Владимировна.
Методические указания рассмотрены и одобрены на заседании кафедры органической, биологической и физколлоидной химии 25.06.07г. протокол №7
РЕЦЕНЗЕНТ: кандидат химических наук, доцент кафедры органической, биологической и физколлоидной химии Пащенко Константин Петрович
Теоретическая часть.
Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующую с ионным проводником (электролитом).
Электродные процессы представляют собой окислительно-восстановительные реакции, протекающие на электродах. В ходе этих реакций происходит переход электрических зарядов из одной фазы в другую, в результате чего на поверхности одной фазы сосредоточиваются отрицательные заряды, на поверхности другой — положительные, а в итоге на границе раздела фаз создается двойной электрический слой, которому соответствует определенный скачок потенциала.
Электронопроводящая фаза (металл, уголь, графит и пр.), вместе с раствором или расплавом электролита образует полуэлемент. Гальванический элемент состоит из двух электродов; каждый из них имеет свой собственный электрический потенциал, называемый электродным потенциалом.
При изучении количественной стороны явлений, наблюдаемых на границе металл — раствор, было установлено, что величина равновесного электродного потенциала EMe/Men+ зависит от природы металла, из которого приготовлен электрод, температуры и концентрации ионов металла в растворе соли. Зная эти величины, можно вычислить электродный потенциал по уравнению Нернста:
EMe/Mez+=E0Me/Mez+ +  ,где (1)
,где (1)
n — число электронов, которое теряет атом металла, превращаясь в ион Меz+, или приобретает ион металла при восстановлении;
R — универсальная газовая постоянная, равная 8,314 Дж/(К • моль);
T— абсолютная температура, К;
F— постоянная Фарадея;
C — концентрация ионов металла в данном растворе, моль/л;
Е° — стандартный электродный потенциал.
Подставив в уравнение (1) числовые значения Rи Fи учтя модуль перехода от натурального логарифма к десятичному, получим формулу для теоретического вычисления величины электродного потенциала при любых температурах:
EMe/Mez+=E0Me/Mez+ +  (2)
(2)
При стандартной температуре 250С или 298 К:
EMe/Mez+=E0Me/Mez+ + 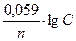 (3)
(3)
Формулы (2) и (3) применимы для разбавленных растворов. В случае концентрированных растворов в указанные уравнения вместо концентраций ионов подставляют их активности:
EMe/Mez+=E0Me/Mez+ +  аМеz+,(4)где
аМеz+,(4)где
аМеn+ — активность ионов данного металла в растворе.
Если принять концентрацию или активность ионов металла в растворе равной единице, то Е=Е°.Следовательно, величина Е° представляет собой электродный потенциал данного металла, погруженного в раствор, в котором концентрация ионов металла равна 1 моль/л(или аМеn+= 1). Его называют нормальным электродным потенциалом. Величины нормальных потенциалов различны у разных металлов, их определяют опытным путем.
Электродвижущая сила электрохимической цепи равна алгебраической сумме скачков потенциала, возникающих на границе всех фаз.
Существует две теории электродного потенциала: осмотическая и сольватационная.
Осмотическая теория электродного потенциала была предложена В. Нернстом в 1890 г. Она основана на трех положениях.
1. Электродный потенциал определяется скачком потенциала на границе металл — раствор.
2. Электродный потенциал возникает только в результате обмена ионами между металлом и раствором.
3. Движущими силами обмена ионами являются осмотическое давление πрастворенного вещества и электрохимическая упругость растворения металла (Р).
Согласно теории Нернста, при погружении металла в раствор, содержащий его ионы, сразу же начинается обмен ионами между металлом и раствором. В зависимости от природы металла и состава раствора возможны три случая:
1) π > P – происходит переход ионов из раствора в металл (  - положителен);
- положителен);
2) π < P – происходит переход ионов из металла в раствор (  - отрицателен);
- отрицателен);
3) π = Р – состояние равновесия между раствором и металлом (  =0).
=0).
Нернст считал, что к растворам электролитов применимы законы идеальных газов, поэтому осмотическое давление раствора можно выразить через концентрацию соответствующих ионов π = RTС, откуда

Если концентрация СMz+=1 моль/л, то
 , где
, где
 — нормальный потенциал. Поэтому можно написать следующее выражение для электродного потенциала:
— нормальный потенциал. Поэтому можно написать следующее выражение для электродного потенциала:

Это уравнение Нернста не отличается от общего термодинамического уравнения для электродного потенциала. Если вместо концентрации подставить активность, то нормальный потенциал Нернста будет тождественным со стандартным потенциалом.
Сольватационная теория электродного потенциала была впервые предложена Л. В. Писаржевским (1912—1914). Согласно этой теории, при возникновении электродного потенциала главными процессами являются:
1) ионизация электрода металла с появлением в нем ионов и свободных электронов

2) взаимодействие растворителя с ионами металла Мz+ находящимися в кристаллической решетке,
Первый процесс не противоречит современным представлениям о природе металлического состояния, согласно которому в узлах кристаллической решетки металла располагаются его ионы, находящиеся в равновесии с обобществленными валентными электронами. Второй процесс является результатом взаимодействия ионов металла с молекулами растворителя, а не результатом электролитической упругости растворения. Свойства сольватированных ионов зависят от природы растворителя.
В электрохимической цепи различают внешнюю и внутреннюю цепь. Внешняя цепь — это выводы электродов и прибор для измерения ЭДС. Внутренняя цепь представляет собой гальванический элемент.