 |
|
Обработка результатов измерений
1. По формуле (10) рассчитать для каждого опыта значение мощности электрического тока  . Результаты занести в таблицу.
. Результаты занести в таблицу.
2. По формуле (11) рассчитать для каждого опыта сопротивление нити  . Результаты занести в таблицу.
. Результаты занести в таблицу.
3. Используя данные таблицы, вычислить  (i – номер опыта, i =1, 2,…, 5). Результаты записать в таблицу.
(i – номер опыта, i =1, 2,…, 5). Результаты записать в таблицу.
4. Рассчитать по формуле (7) величину коэффициента теплопроводности воздуха для каждого вычисленного значения отношения  , значение параметра
, значение параметра  приведено в таблице.
приведено в таблице.
5. Вычислить по полученным данным среднее значение коэффициента теплопроводности воздуха.
6. Рассчитать абсолютную  и относительную (
и относительную (  ) погрешности определения теплопроводности воздуха (применить методику обработки результатов косвенных невоспроизводимых измерений).
) погрешности определения теплопроводности воздуха (применить методику обработки результатов косвенных невоспроизводимых измерений).
7. Записать конечный результат в виде:

8. Заполнить таблицу. Сделать выводы по результатам работы.
Таблица
| № опыта | 
| 
| 
| 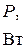
| 
|  , ,

|  , ,

|  , ,

|
| 1,00 | ||||||||
| 2,00 | ||||||||
| 3,00 | ||||||||
| 4,00 | ||||||||
| 5,00 | ||||||||
| 6,00 | ||||||||

|
Контрольные вопросы
1. Какой процесс называется теплопроводностью?
2. От каких величин зависит поток тепла при теплопроводности? Как выглядит закон Фурье?
3. От каких параметров зависит коэффициент теплопроводности? Какова его размерность?
4. От каких параметров зависит тепловой поток в данной лабораторной установке в установившемся режиме, в случае, когда коэффициент теплопроводности является константой?
5. Как выглядит и какие параметры содержит расчётная формула для коэффициента теплопроводности?
6. Каков порядок выполнения работы?
Лабораторная работа 2–6
ИЗУЧЕНИЕ ЭФФЕКТА ДЖОУЛЯ–ТОМСОНА
Цель работы: изучение эффекта Джоуля–Томсона.
Приборы и принадлежности:лабораторный модуль, приборный модуль.
Краткая теория
Молекула любого газа далека от воображаемого упругого шарика исчезающе малого размера (то есть от материальной точки), не взаимодействующего на расстоянии с другими такими же шариками. На самом деле силы взаимодействия между молекулами есть всегда. На больших расстояниях молекулы притягиваются друг к другу, на малых – отталкиваются. Такая особенность сил взаимодействия между молекулами указывает на то, что потенциальная энергия их взаимодействия с увеличением расстояния между молекулами сначала убывает, а начиная с некоторого расстояния Rp растёт. Расстояние Rp (его называют равновесным) является важной величиной, характеризующей реальные газы.
На этом расстоянии силы притяжения и отталкивания между молекулами равны между собой. Уравнение Менделеева–Клапейрона не учитывает этих особенностей взаимодействия молекул в газах и в силу этого применимо не всегда. Более точным уравнением, в котором в значительной степени учитывается взаимодействие молекул, является уравнение Ван-дер-Ваальса, которое применительно к одному молю газа имеет вид:
 (1)
(1)
Это уравнение отличается от уравнения состояния идеального газа  наличием поправок в давление (
наличием поправок в давление (  ) и объеме (
) и объеме (  ), которые учитывают присутствие сил притяжения и сил отталкивания соответственно. Коэффициенты
), которые учитывают присутствие сил притяжения и сил отталкивания соответственно. Коэффициенты  и
и 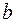 учитывают специфику конкретного газа:
учитывают специфику конкретного газа:
 (2)
(2)
 (3)
(3)
гдеTкиPк, так называемые, критические температура и давление данного газа. Это параметры, при которых неидеальность газа начинает заметно сказываться. В случае температур ниже Tкизотермы реального газа существенно отличаются от изотерм идеального газа: у них появляются точки перегиба.
 Убедительным экспериментальным подтверждением наличия сил межмолекулярного взаимодействия в газах является эффект Джоуля–Томсона. Он состоит в изменении температуры газа в результате адиабатического дросселирования – медленного протекания газа по трубе под действием перепада давления сквозь дроссель – препятствие в виде пористой перегородки на пути потока.
Убедительным экспериментальным подтверждением наличия сил межмолекулярного взаимодействия в газах является эффект Джоуля–Томсона. Он состоит в изменении температуры газа в результате адиабатического дросселирования – медленного протекания газа по трубе под действием перепада давления сквозь дроссель – препятствие в виде пористой перегородки на пути потока.
В опытах Джоуля и Томсона (см. рис. 1) измерялась температура в двух последовательных сечениях AB A1B1 непрерывного и стационарного потока газа до дросселя
MNM1N1 и за ним. Из-за значительного трения в дросселе (мелкопористой пробке из ваты) скорость газового потока была очень малой и кинетическая энергия потока при дросселировании практически не менялась. Благодаря низкой теплопроводности стенок трубы и дросселя теплообмен между газом и внешней средой отсутствовал, что делало весь процесс адиабатическим. Джоуль и Томсон получили, что при перепаде давления на дросселе  равном атмосферному давлению,
равном атмосферному давлению,  составило для воздуха –0,25 ºC (опыт проводился при комнатной температуре). Для CO2 и H2 в тех же условиях
составило для воздуха –0,25 ºC (опыт проводился при комнатной температуре). Для CO2 и H2 в тех же условиях  оказалось –1,25 и
оказалось –1,25 и
+0,02 ºC. Эффект Джоуля–Томсона принято считать положительным, если газ в процессе дросселирования охлаждается (  ) и отрицательным, если газ нагревается (
) и отрицательным, если газ нагревается (  ).
).
Качественное объяснение эффекта Джоуля–Томсона состоит в следующем. При уменьшении давления газа (P2 < P1) уменьшается концентрация молекул и увеличивается среднее расстояние между ними. Если расстояние между молекулами первоначально больше Rp, то его дальнейшее увеличение приводит к ослаблению сил притяжения и увеличению потенциальной энергии взаимодействия молекул. В отсутствие притока тепла рост потенциальной энергии происходит за счет уменьшения кинетической энергии молекул. Следовательно, температура газа уменьшается. Другая картина имеет место, если среднее расстояние между молекулами меньше Rp. Увеличение среднего расстояния между молекулами при условии, что оно остаётся меньше Rp, приводит к уменьшению потенциальной энергии их взаимодействия, а значит к увеличению кинетической энергии газа. В этом случае после прохождения дросселя температура газа становится выше, чем была. Температура, при которой эффект Джоуля–Томсона меняет знак, называется температурой инверсии Ti. Для каждого газа она своя. Значение температуры инверсии можно оценить по формуле  .
.
Количественной мерой, характеризующей эффект Джоуля–Томсона, является величина  . Её значение связано с параметрами реального газа. Рассмотрим порцию газа массой 1 моль, занимающего перед дросселем объем V1, а сразу за дросселем – объем V2 (см. рис. 1). Внешняя сила, поддерживающая перепад давления
. Её значение связано с параметрами реального газа. Рассмотрим порцию газа массой 1 моль, занимающего перед дросселем объем V1, а сразу за дросселем – объем V2 (см. рис. 1). Внешняя сила, поддерживающая перепад давления  , совершает при проталкивании этой порции газа через сечение дросселя
, совершает при проталкивании этой порции газа через сечение дросселя  работу:
работу:
 ,
,
газ при постоянном давлении  полностью вытесняется из объёма, расположенного слева от дросселя (см. рис. 1).
полностью вытесняется из объёма, расположенного слева от дросселя (см. рис. 1).
Газ, прошедший через сечение M1N1 дросселя, вытесняя газ, находившийся за дросселем, уже сам совершает работу:
 ,
,
(P2 – давление газа по другую сторону дросселя).
Полная работа газа равна:
 . (4)
. (4)
Поскольку процесс дросселирования адиабатический, согласно первому началу термодинамики работа совершается газом за счёт изменения его внутренней энергии  :
:
 , (5)
, (5)
где U1 – внутренняя энергия газа слева от дросселя, U2 – справа (см. рис. 1).
Объединяя (4) и (5), можно записать:
 . (6)
. (6)
Из (6) следует, что в адиабатическом процессе выполняется соотношение:
 . (7)
. (7)
Термодинамическая функция  называется энтальпией. Из (7) следует, что в адиабатическом процессе дифференциал энтальпии равен нулю, то есть имеет место равенство:
называется энтальпией. Из (7) следует, что в адиабатическом процессе дифференциал энтальпии равен нулю, то есть имеет место равенство:
 . (8)
. (8)
При небольших перепадах давления при замене в (8) дифференциалов конечными приращениями, используя для их нахождения (1), для искомой величины  можно приближённо записать:
можно приближённо записать:
 , (9)
, (9)
где  – молярная теплоемкость газа при постоянном давлении;
– молярная теплоемкость газа при постоянном давлении;  средняя температура газа.
средняя температура газа.
Описание установки
 В лабораторной работе опыт Джоуля–Томсона воспроизводится на специальном стенде (рис. 2). Воздух прокачивается по трубопроводу, содержащему в качестве дросселя текстолитовую гильзу с запрессованным войлоком. Избыточное по сравнению с атмосферным давление создается встроенным компрессором и измеряется манометром. Для измерения разности температур газа на входе и выходе воздушного потока используется хромель-копелевая термопара. Один её спай находится по одну сторону дросселя, другой – по другую. На передней панели стенда расположены милливольтметр 1 для измерения термоЭДС термопары, манометр 2, вентиль 3, обеспечивающий избыточное давление в пределах (0…0,6 МПа), тумблер включения термопары 4, тумблер включения компрессора 5, тумблер включения питания «Сеть» 6, штуцер подсоса газа 7.
В лабораторной работе опыт Джоуля–Томсона воспроизводится на специальном стенде (рис. 2). Воздух прокачивается по трубопроводу, содержащему в качестве дросселя текстолитовую гильзу с запрессованным войлоком. Избыточное по сравнению с атмосферным давление создается встроенным компрессором и измеряется манометром. Для измерения разности температур газа на входе и выходе воздушного потока используется хромель-копелевая термопара. Один её спай находится по одну сторону дросселя, другой – по другую. На передней панели стенда расположены милливольтметр 1 для измерения термоЭДС термопары, манометр 2, вентиль 3, обеспечивающий избыточное давление в пределах (0…0,6 МПа), тумблер включения термопары 4, тумблер включения компрессора 5, тумблер включения питания «Сеть» 6, штуцер подсоса газа 7.