 |
|
Свойства внутренней энергии
1. В состоянии термодинамического равновесия частицы, входящие в состав макроскопических тел, движутся так, что их полная энергия все время с высокой точностью равна внутренней энергии тела.
2. Внутренняя энергия является функцией состояния физической системы.
3. Внутренняя энергия физической системы не зависит от пути перехода ее из одного состояния в другое, а определяется только значением внутренней энергии в начальном и конечном состояниях:
DU = U2 - U1.
4. Внутренняя энергия характеризуется свойством аддитивности, т. е. она равна суммарной внутренней энергии тел, входящих в систему.
Замечание: частицы газа, кроме поступательных степеней свободы, имеют еще и внутренние.
Например, если частицами газа являются молекулы, то, кроме электронного движения, возможно вращение молекул, а также колебания атомов, входящих в состав молекул.
Поступательное движение частиц газа подчиняется классическим законам, а их внутренние движения носят квантовый характер.
Лишь при определенных условиях внутренние степени свободы можно считать классическими.
Для расчета внутренней энергии идеального газа используют закон равнораспределения энергии по классическим степеням свободы.
В случае идеального газа учитывается только кинетическая энергия поступательного движения частиц.
Если частицами газа являются отдельные атомы, то каждый имеет три поступательные степени свободы.
Следовательно, каждый атом обладает средней кинетической энергией:
< ek > = 3kT/2.
Если газ состоит из N атомов, то его внутренняя энергия
 . (1.25)
. (1.25)
Если же идеальный газ состоит из молекул, то необходимо учитывать еще и вращательные степени свободы.
Например, молекулы водорода - Н2, кислорода - О2, азота - N2 имеют две вращательные степени свободы (iвр = 2).
Тогда вклад во внутреннюю энергию идеального газа вращательных степеней свободы
 . (1.26)
. (1.26)
Если же возбуждаются еще и колебательные степени свободы молекул, то вклад их во внутреннюю энергию
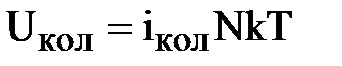 . (1.27)
. (1.27)
В формуле (1.27) учтено, что каждое колебательное движение молекул характеризуется средней кинетической и средней потенциальной энергиями, которые равны между собой.
Поэтому согласно закону равнораспределения энергии по степеням свободы на одну колебательную степень свободы приходится в среднем энергия kT.
Таким образом, если молекула двухатомная, то полное число степеней свободы ее i = 6.
Три из них поступательные (iпост = 3), две вращательные (iвр= 2) и одна колебательная (iкол = 1).
При температурах, когда еще «заморожены» колебательные степени свободы, внутренняя энергия двухатомных молекул идеального газа
 .
.
Если же колебательные степени свободы «разморожены», то внутренняя энергия двухатомных молекул идеального газа
U = Uпост + Uвр + Uкол = 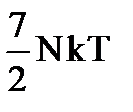 .
.
Таким образом, внутренняя энергия одноатомного идеального газа
U = N < ek > =  , (1.28)
, (1.28)
где < ek > =  .
.
Число молей газа
n = N/ Na = m / M,
то
 =
= 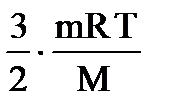 , (1.29)
, (1.29)
где R – универсальная газовая постоянная, m – масса газа.
Для многоатомных газов
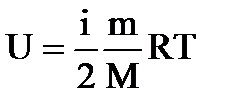 , (1.30)
, (1.30)
Вывод:
Из-за отсутствия взаимодействия между молекулами идеального газа внутренняя энергия его зависит от числа частиц, температуры и не зависит от объема (закон Джоуля).