 |
|
Крекинг и пиролиз нефтепродуктов
Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании
С4Н10  С4Н8 + Н2
С4Н8 + Н2
3. Из галогенпроизводных, действуя спиртовым раствором щелочи:
спирт
CH3 − CН − CH − CH3 + КОН  CH3 − C=CH − CH3 + KBr + Н2О
CH3 − C=CH − CH3 + KBr + Н2О
| | |
СН3 Br СН3
4. Из спиртов в присутствии кислоты при нагревании:
Н+
CH3 − CH 2 − CH2 − ОН  CH3 − CН = CH2 + Н2О
CH3 − CН = CH2 + Н2О
Н+
СH3 − CН(ОН) − CH2−CH3  CH3 − CН = CH− CH3 + Н2О
CH3 − CН = CH− CH3 + Н2О
Отщепление воды и галогеноводородов происходит по правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода, т.е. атома, который связан с меньшим числом атомов водорода.
5. Из дигалогенпроизводных под действием активных двухвалентных металлов(Zn, Mg) при нагревании.
CH3−CН−CH −СН2−СН3 + Zn  CH3−CН = CH−СН2−CH3 + ZnBr2
CH3−CН = CH−СН2−CH3 + ZnBr2
| |
Br Br
3.2.Химические свойства алкенов
1.Для алкенов характерны реакции электрофильного присоединения(ионного) АЕ , которые протекают с разрывом π- связи.
а) Гидрированиекаталитическое (Ni, Pt, Pd) при нагревании :
CH3−CН = CH2 + Н2  CH3−CН2−CH3
CH3−CН2−CH3
б) Галогенирование ( Hal2- Cl2, Br2, I2): Br Br
CCl4 или Н2О | |
CH3−C=CH2 + Br2  CH3−C – CH2
CH3−C – CH2
| |
CH3 CH3
в) Гидрогалогенирование - присоединение HHal( HCl, HBr, HI)
CH3−C=CH−CH3 + HBr  CH3−CBr– CH2−CH3
CH3−CBr– CH2−CH3
| |
CH3 CH3
г)Гидратация -присоединение воды в кислой среде при нагревании:
OH
|
CH3−C=CH−CH3 + H2O  CH3−C– CH2−CH3
CH3−C– CH2−CH3
| |
CH3 CH3
Присоединение галогеноводородов и воды в основном протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода, т.е. к атому, который связан с большим числом атомов водорода. Но есть исключения из этого правила.
CH2−CH=CH2 + HCl  CH2−CH2−CH2Cl
CH2−CH2−CH2Cl
| |
NO2 NO2
CH2=CH−COOH + HBr  CH2−CH2−COOH
CH2−CH2−COOH
|
Br
2. Реакции полимеризации:
t
n CH3−CH=CH2  (−CH−CH2−)n
(−CH−CH2−)n
AlCl3 |
СН3
Реакции окисления
а) реакции мягкого окисления водным раствором перманганата калия
-1 -2 +7 0 -1
3 CH3−CH=CH2 + 2 KMnO4 + 4 H2O  3 CH3−CH−CH2 + 2 KOH +
3 CH3−CH−CH2 + 2 KOH +
+2MnO2 | |
OH OH
-1 0
C - 1 е → C
-2 -1 процесс окисления
C - 1 е → C
+7 +4
Mn + 3 е → Mn процесс восстановления
Эта реакция обесцвечивания раствора перманганата калия является качественной реакцией на алкены, как и реакция обесцвечивания бромной воды.
в) действие жестких окислителей ( азотной кислоты, перманганата калия и дихромата калия в кислой среде) приводит к разрыву молекулы алкена по месту расположения двойной связи с образованием кислот и кетонов:
CH3CH=CH + 2KMnO4 + 3H2SO4  CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
CH3−C(CH3) = CH –CH3 + K2Cr2O7 + 4H2SO4 
CH3−C(O)СН3 + CH3COOH + Cr2(SO4)3 + 4H2O + K2SO4
ацетон
г) каталитическое окисление кислородом:
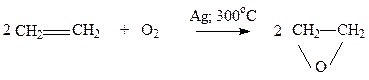
д) реакции горения
CnH2n + 3n/2 O2  nCO2 + n H2O
nCO2 + n H2O
3.3.Примеры решения задач
Пример 12. Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 3,6, пропустили над нагретым никелевым катализатором. При этом образовалась газовая смесь с плотностью по водороду 4,23. Определить выход в реакции гидрирования и состав полученной газовой смеси (в % по объему).
Решение:
Поскольку в условии задачи заданы только относительные значения
( т.е. величины, не зависящие от количества вещества – относительная плотность) и необходимо определить также относительные величины
( состав, выход в реакции), для упрощения расчетов зададимся каким-либо абсолютным значением.
1) Пусть количество моль исходной смеси n(см1) =1 моль,
Исходная газовая смесь(смесь 1): С2H4 и H2
2) Вычислим среднюю молярную массу этой смеси
Мср. (см1)= D(см1)∙М(Н2) = 3,6 ∙ 2 = 7,2 г/моль,
3) Тогда масса смеси (1):
m(см1) = М (см1) ∙ n(см1) = 7,2 ∙ 1 = 7,2 г.
4) Пусть n(С2H4)= х моль; n(H2)= у моль.
Составим систему уравнений и решаем её:
х + у = 1 x = 0,2
28 х + 2у = 7,2 y = 0,8
Таким образом, исходная смесь состоит из 0,8 моль С2H4 и 0,2 моль H2.
5) После реакции гидрирования:
С2H4 + H2 = С2H6
получим смесь (2): С2H4, H2 и С2H6.
Вычислим среднюю молярную массу этой смеси
Мср. (см2)= D(см2)∙М(Н2) = 4,23 ∙ 2 = 8,46 г/моль.
6) Поскольку, согласно закону сохранения массы, общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции; масса газовой смеси в результате гидрирования не меняется,
m(см1) = m (см2) = 7,2 г.
7) Вычислим количество вещества конечной газовой смеси (смеси 2):
n(см2)= m (см2)/ M(см2) = 7,2 ׃ 8,46 = 0,851моль.
8) Пусть, в реакцию вступает z(моль) H2, тогда в реакцию ступает также z моль С2H4 и в результате реакции образуется z моль С2H6.
Было 0,8 0,2
С2H4 + H2 = С2H6
Прореагировало z z стало z
Запишем эти данные для удобства в виде таблицы
| Вещества | Было(моль) | Прореаг.(моль) | Стало(моль) |
| С2Н4 | 0,8 | Z | 0,8 – z |
| Н2 | 0,2 | Z | 0,2 – z |
| С2Н6 | - | - | z |
| ∑(n) | 1,0 | 2z | 1 - z |
9) Определим количества всех веществ в конечной газовой смеси(2):
n(см2)= n(С2Н4)+ n(Н2)+n(С2Н6)= (0,8-z)+(0.2-z)+z=1-z= 0,851
Отсюда z= 1-0,851=0,149
В смеси (2):
n(С2Н4)= 0,8-0,149=0,651 моль
n(Н2)= 0,2-0,149=0,051 моль
n(С2Н6)=0,149моль
10) Выход в реакции гидрирования вычисляем как отношение количества вещества С2Н6, полученное практически, к количеству вещества, рассчитанному по уравнению химической реакции (т.е. теоретически).
Количество вещества С2Н6, полученное по реакции теоретически, рассчитываем по недостатку. В смеси (1) водород находится в недостатке. Следовательно n(С2Н6)теор= 0,2 моль
η (С2Н6)=0,149/0,2= 0,745 (74,5%)
11) Определяем состав полученной газовой смеси (в % по объему)
φ( в-ва)=V(в-ва)/V(см2)∙100%= n(в-ва)/n(см2)∙100%
φ(С2Н6)=0,149:0,851∙100%= 17,51% φ(С2Н4)=0,651:0,851∙100%= 76,50%
φ(Н2)=0,051:0,851∙100%= 5,99%
Ответ: φ(С2Н6)=17,51%; φ(С2Н4)= 76,50%; φ(Н2)= 5,99%
η (С2Н6)=74,5%
Пример13.В молекуле нециклического углеводорода sp3 – гибридизованных атомов углерода равно трем, , а sp2- гибридизованных – двум. Установите строение этого углеводорода, если в его составе содержится только один третичный атом углерода. Какая масса бромоводорода может вступить в реакцию с 14 г этого углеводорода. Определить массовую долю брома как элемента в полученном бромпроизводном .
Решение:
1) Условию задачи отвечает следующее строение:
sp3 sp3 sp2 sp2
CH3-CH –CH= CH2 - 3-метилбутен-2 C5H10
|
CH3
sp3
2) Запишем реакцию взаимодействия алкена с бромоводородом
CH3−CH−CH= CH2 + HBr  CH3−CH −CH −CH3
CH3−CH −CH −CH3
| | |
CH3 CH3 Br
2-бром-3метилбутан
Реакция протекает по правилу Марковникова.
М(C5H10) = 70 г/моль, n(C5H10) = 14 / 70 = 0,5 моль.
В соответствии с уравнением реакции n(HBr) = n (C5H10) =0,5 моль,
m ( HBr) = n ( HBr) ∙ М ( HBr) = 0,5 ∙ 81 = 40,5 (г)
3) Определяем массовую долю брома в полученном бромпроизводном C5H11Br ω (Br) = Ar( Br)∙n(Br)/ Mr(C5H11Br),
где Ar (Br) –относительная атомная масса Br,
n (Br)- число атомов брома в молекуле,
Mr (C5H11Br)- относительная молекулярная масса бромпроизводного
ω (Br) =80∙1/149= 0,5369 (53,69%)
Ответ: 3-метилбутен-2; ω (Br) =53,69%
Пример14. Определить массу 1,2 дихлорпропана, необходимую для получения 3,36 г пропена, учитывая, что реакция взаимодействия
1,2- дихлорпропана с избытком цинка проходит с выходом 72,7%.
Решение:
1) Реакция получения пропена :
t
CH3−CH −CH2 +Zn  СН3−СН=СН2 +ZnCl2
СН3−СН=СН2 +ZnCl2
| |
Cl Cl
2) Вычисляем количество полученного пропена практически
n (С3Н6) = m (С3Н6)/М (С3Н6)= 3,36: 42 = 0,08 моль.
3) Следовательно, n (С3Н6Cl2), вступающего в реакцию, также равно
0,08 моль.
4) С учетом того, что выход в реакции равен отношению количества вещества практически вступающего в реакцию n(пр.), к количеству вещества, вступающего в реакцию теоретически n(теор.), определяем количество вещества С3Н6Cl2, взятого для реакции
η = n(пр) /n(теор) ∙ 100% ═> n(теор)= n (пр) : η =0,08 :0.727= 1,1 моль.
5) Масса 1,2-дихлорпропана, взятая для реакции:
m(С3Н6Cl2)= 0,11∙ 111=12,2 (г)
Ответ: m(С3Н6Cl2)= 12,2 г