 |
|
ЧИСЛО СОУДАРЕНИЙ И СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА.
РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ В ПОТЕНЦИАЛЬНОМ ПОЛЕ
СИЛ ТЯЖЕСТИ (РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
При выводе основного уравнения МКТ газов и распределения Максвелла предполагалось, что на молекулы газа внешние силы не действуют, а это значит, что молекулы распределяются по объему равномерно. Однако молекулы любого газа всегда находятся в потенциальном поле сил тяжести Земли. Тяготение с одной стороны, и тепловое движение молекул – с другой приводят к некоторому стационарному состоянию, при котором давление газа с ростом высоты убывает.
Получим закон изменения давления с высотой, предполагая, что по всей высоте: поле тяготения однородно (g = const); температура одинакова (Т = const); массы всех молекул одинаковы.
 Пусть на высоте h давление р. Тогда на высоте h + dh давление – р + dp. Причём, если dh >0, то dp < 0. (р + dp) – р = – r·g·dh. Из уравнения состояния Менделеева-Клапейрона, имеем:
Пусть на высоте h давление р. Тогда на высоте h + dh давление – р + dp. Причём, если dh >0, то dp < 0. (р + dp) – р = – r·g·dh. Из уравнения состояния Менделеева-Клапейрона, имеем:
 .
.
Теперь  или
или 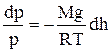 .
.
Интегрируем правую и левую часть:
 ;
;  .
.
Откуда,  . (26)
. (26)
Это так называемая барометрическая формула. Она позволяет определять давление атмосферы как функцию высоты над уровнем моря:
 . (27)
. (27)
Т.к. давление прямо пропорционально концентрации молекул, то можно получить закон изменения концентрации молекул с высотой при условии, что температура с высотой не меняется (Т = const):

 . (28)
. (28)
Учитывая, что М = m∙NA, а R = k∙NA из (27) получим:
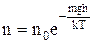 . (29)
. (29)
Т.к. mgh = U(h) – потенциальная энергия одной молекулы на высоте h, то
 (30)
(30)
– распределение Больцмана.
ЧИСЛО СОУДАРЕНИЙ И СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА.
Молекулы газа в результате хаотического движения непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекула проходит некоторый путь λ, который называется длиной свободного пробега. В общем случае длина этого пути различна, но т.к. число столкновений очень велико, а движение беспорядочно, то при постоянных внешних условиях можно говорить о средней длине свободного пробега –  . Если молекулы данного газа испытывают за 1 секунду в среднем
. Если молекулы данного газа испытывают за 1 секунду в среднем 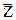 столкновений, то
столкновений, то
 , (30)
, (30)
где  – средняя арифметическая скорость молекул.
– средняя арифметическая скорость молекул.
Молекулы идеального газа мы рассматриваем как шарики. Очевидно, что соударение произойдет, если две молекулы сблизятся до расстояния равного двум радиусам, т. е. диаметру молекул d. Минимальное расстояние, на которое сближаются при соударении центры двух молекул, называется эффективным диаметром молекул. Этот параметр зависит от  , а значит и от температуры газа.
, а значит и от температуры газа.
Для определения 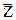 представим себе молекулу с эффективным диаметром d, которая движется со скоростью
представим себе молекулу с эффективным диаметром d, которая движется со скоростью  среди других молекул, которые при этом остаются неподвижными. Эта молекула столкнется со всеми молекулами, центры которых лежат внутри "ломаного" цилиндра радиусом d. Это значит, что
среди других молекул, которые при этом остаются неподвижными. Эта молекула столкнется со всеми молекулами, центры которых лежат внутри "ломаного" цилиндра радиусом d. Это значит, что 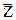 равно числу молекул в объеме этого цилиндра
равно числу молекул в объеме этого цилиндра
 , (31)
, (31)
 где n – концентрация молекул, а V–объём цилиндра:
где n – концентрация молекул, а V–объём цилиндра:  . С учётом этого –
. С учётом этого –
 . (32)
. (32)
Учет движения других молекул увеличивает число столкновений в 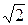 раз. Окончательно для z получим:
раз. Окончательно для z получим:
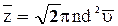 . (33)
. (33)
Тогда 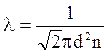 (34)
(34)
Т.к. p ~ n, то для разных внешних условий имеем:
 (35).
(35).
Для воздуха при н.у. (р = 760мм.рт.ст.; t0 = 00 С ): z = 109 c-1, а 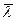 = 5∙10-8 м.
= 5∙10-8 м.
ЯВЛЕНИЯ ПЕРЕНОСА
В термодинамически неравновесных системах, т.е. в системах, для которых значения макропараметров (Т, р,  ) в разных ее точках различны, возникают необратимые процессы, получившие название явлений переноса. В результате таких процессов из одной локальной области системы в другую происходит перенос энергии (явление теплопроводности), массы (явление диффузии), импульса (внутреннее трение), заряда и т.д. Это ведет к выравниванию значений макропараметров по объему системы. Понятно, что перенос любой величины объясняется переходом с места на место некоторого числа частиц (молекул и атомов) в результате их хаотического движения.
) в разных ее точках различны, возникают необратимые процессы, получившие название явлений переноса. В результате таких процессов из одной локальной области системы в другую происходит перенос энергии (явление теплопроводности), массы (явление диффузии), импульса (внутреннее трение), заряда и т.д. Это ведет к выравниванию значений макропараметров по объему системы. Понятно, что перенос любой величины объясняется переходом с места на место некоторого числа частиц (молекул и атомов) в результате их хаотического движения.
 Получим общее уравнение переноса вдоль произвольного направления. Направим вдоль него ось Ох (рис 3). Выделим мысленно элемент плоскости площадью ∆S, перпендикулярный Ох. В силу хаотичности движения за время ∆t через ∆S в направлении Ох переместится N частиц:
Получим общее уравнение переноса вдоль произвольного направления. Направим вдоль него ось Ох (рис 3). Выделим мысленно элемент плоскости площадью ∆S, перпендикулярный Ох. В силу хаотичности движения за время ∆t через ∆S в направлении Ох переместится N частиц:
 (1)
(1)
Здесь n – концентрация молекул (атомов), а  – их средняя арифметическая скорость. Переходя через ∆S, каждая молекула переносит присущие ей массу, заряд, импульс, энергию или какие-то другие свои характеристики. Обозначим значение величины, переносимое одной молекулой буквой φ. Тогда за время ∆t через площадку ∆S в направлении оси Ох будет перенесено количество физической величины
– их средняя арифметическая скорость. Переходя через ∆S, каждая молекула переносит присущие ей массу, заряд, импульс, энергию или какие-то другие свои характеристики. Обозначим значение величины, переносимое одной молекулой буквой φ. Тогда за время ∆t через площадку ∆S в направлении оси Ох будет перенесено количество физической величины
 (2).
(2).
Очевидно, если концентрация справа тоже n, то и справа налево перейдет столько же частиц. Т.е. результирующий перенос в этом случае равен нулю: ΔN = 0 и ΔNφ = 0.
Если же среда неоднородна, т.е. либо концентрация частиц, либо значения φ для частиц слева и справа неодинаковы, то более вероятными будут переходы из областей, где значение (nφ) больше в области, где оно меньше. Если предположить, что (nφ)1 > (nφ)2 , то результирующий перенос величины φ будет определяться соотношением:  . (3)
. (3)
Знак «минус» в (3) отражает факт убыли величины (nφ) в направлении переноса.
Выясним, на каком расстоянии от ∆S слева и справа следует взять значения (nφ). Т.к. изменение физических характеристик молекул происходит только при соударениях, а до соударения каждая из молекул прошла расстояние равное длине свободного пробега, то можно считать, что (nφ) молекул сохраняются неизменными на расстоянии, равном длине свободного пробега 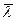 влево и вправо от ∆S. Разделим и умножим правую часть (3) на 2
влево и вправо от ∆S. Разделим и умножим правую часть (3) на 2 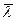 :
:
 (4)
(4)
Распределение величин вдоль какого-либо направления определяется характеристикой, которая называется – градиент. Градиент это изменение величины на расстоянии равном единице длины.
В данном случае, в точке с координатой х2 значение перенасимой величины – (nφ)2, а в точке х1 – (nφ)1, тогда под градиентом величины nφ, переносимой вдоль оси Ох, следует понимать отношение:
 .
.
Тогда  градиент величины nφ в области ∆S.
градиент величины nφ в области ∆S.
 . (5)
. (5)
(5) – общее уравнение переноса.
Диффузия – это перенос массы вещества. При условии, что массы молекул одинаковы (m0 = const), температура газа по объёму одинакова (T = const) и однородного по объему распределения скоростей (  = const), подставляя вместо φ массу молекулы в (5), получим:
= const), подставляя вместо φ массу молекулы в (5), получим:
 , или
, или  . (6)
. (6)
Это закон Фика. D =  – коэффициент диффузии. [D] = м2/с.
– коэффициент диффузии. [D] = м2/с.
Теплопроводность – это перенос энергии. При условии, что по всему объему газа концентрация молекул (n = const), массы молекул одинаковы (m0 = const), распределение скоростей по объёму однородно (  = const), а средняя кинетическая энергия поступательного движения одной молекулы
= const), а средняя кинетическая энергия поступательного движения одной молекулы  , получим закон Фурье:
, получим закон Фурье:
 , или
, или  . (7)
. (7)

– коэффициент теплопроводности. [χ] = Вт/(м·К) = кг·м/(с3·К).
Вязкость – это перенос импульса между параллельными слоями, которые упорядоченно движутся со скоростями u1и u2. При условии, что по всему объему газа концентрация молекул n = const, массы молекул одинакова (m0 = const), распределение скоростей по объёму однородно (  = const), а модуль импульса одной молекулы, связанный со скоростью упорядоченного движения слоев φ = р = m0u, для импульса силы взаимодействия слоёв имеем:
= const), а модуль импульса одной молекулы, связанный со скоростью упорядоченного движения слоев φ = р = m0u, для импульса силы взаимодействия слоёв имеем:
 , или
, или  . ()
. ()
Это уравнение Ньютона, которое определяет величину силы внутреннего трения (вязкости).  – поперечный градиент скорости, характеризующий быстроту изменения скорости в направлении х перпендикулярном движению трущихся слоев. η – динамический коэффициент вязкости
– поперечный градиент скорости, характеризующий быстроту изменения скорости в направлении х перпендикулярном движению трущихся слоев. η – динамический коэффициент вязкости  . [η] = Па·с.
. [η] = Па·с.

МОЛЕКУЛЯРНЫЕ СИЛЫ
Силы взаимодействия между молекулами, или, как их еще называют, Ван-дер-Ваальсовские силы имеют электрическую природу. Это кулоновские силы взаимодействия заряженных частиц, из которых состоят атомы и молекулы. Они проявляются на расстояниях, соизмеримых с размерами самих молекул и очень быстро убывают при увеличении расстояния. При этом одновременно действуют силы притяжения (взаимодействие разноименных зарядов) и силы отталкивания (взаимодействие одноименных зарядов). Т.к. реальные частицы не являются точечными, то величина этих сил зависит от расстояния между ними по-разному.
Различают три типа сил Ван-дер-Ваальса:
a) ориентационные – действуют между полярными молекулами:
 ,
,
где р – электрический дипольный момент частиц, r – расстояние между ними, k – постоянная Больцмана, Т – термодинамическая температура.
б) индукционные – описывают взаимодействие молекул, поляризация
зарядов в которых возникает под воздействием электрических полей соседних частиц:
 .
.
Здесь: ринд = ε0αЕ – приобретённый электрический дипольный момент частиц; α – поляризуемость молекул.
в) дисперсионные – определяют взаимодействие молекул, несимметричное распределение зарядов в которых возникает случайно, в процессе движения электронов по орбитам, что и приводит к образованию мгновенных диполей:
 .
.
В общем случае все три типа сил могут действовать одновременно:
Fм = Fо + Fи + Fд.
Рассмотрим зависимость сил межмолекулярного взаимодействия от расстояния. Силы притяжения Fпр считаются отрицательными, а силы отталкивания Fот – положительными. Сумма этих сил дает результирующую – Fрез = f(r). На некотором расстоянии r0 между молекулами |Fпр| = |Fот| и результирующая сила F = Fпр + Fот = 0. Если r < r0, то преобладают силы отталкивания. Если r >r0, то преобладают силы притяжения. Однако на расстоянии r > 10-9 м силы Ван-дер-Ваальса быстро стремятся к нулю.
 Система взаимодействующих молекул характеризуется некоторым запасом потенциальной энергии, которая сложным образом зависит от r, Еп = f(r):
Система взаимодействующих молекул характеризуется некоторым запасом потенциальной энергии, которая сложным образом зависит от r, Еп = f(r):
r → ∞ – Еп → 0 ;
r > r0 и r → r0 – Еп → Еп min , Еп < 0 ;
r = r0 – Еп = Еп min , Еп < 0;
r < r0 и уменьшается – Еп → ∞, Еп > 0.
Наименьшая потенциальная энергия взаимодействия называется энергией связи молекул. Она равна работе, которую необходимо совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии.
Соотношение минимальной потенциальной энергии (Еп min) и величины удвоенной средней энергии теплового движения приходящейся на одну степень свободы  является критерием агрегатного состояния вещества. Если:
является критерием агрегатного состояния вещества. Если:
а) Еп min << kT – газ;
б) Еп min » kT – жидкость;
в) Еп min >> kT – твердое тело.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии.