 |
|
Восстановление более высокоокисленных соединений
а) альдегиды:

пропаналь пропанол-1
б) кетоны:

пропанон пропанол-2
в) кислоты:

уксусная кислота этанол
г) сложные эфиры:
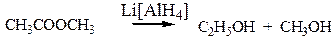
метилацетат этанол метанол
Восстановление по пути а) и б) можно провести с помощью многих восстановителей- амальгама натрия и вода, натрий в спирте, каталитическое восстановление водородом на тонкоизмельчённом никелевом или платиновым катализатором.
Восстановить карбоновые кислоты и их сложные эфиры можно только с помощью сильных восстановителей, таких как алюмогидрид лития LiAlH4.
Биохимические методы.
Например, этанол получается при ферментативном разложении глюкозы:
С6Н12О6  2С2Н5ОН + 2СО2
2С2Н5ОН + 2СО2
8.2. Химические свойства спиртов
Кислотные свойства.
Спирты – чрезвычайно слабые кислоты, они практически не реагируют водными растворами щелочей.Но водород в гидроксильной группе можно заместить путём прямого взаимодействия спирта со щелочными и щелочноземельными металлами, при этом образуются алкоголяты, например:
C2H5OH + Na  C2H5ONa + 0,5H2
C2H5ONa + 0,5H2
этилат натрия
Поскольку спирты – чрезвычайно слабые кислоты, их соли(алкоголяты) – очень сильные основания. Основность алкоголята зависит от типа исходного спирта. В растворе алкоголяты третичных спиртов – более сильные основания, чем алкоголяты вторичных спиртов, которые в свою очередь сильнее, чем алкоголяты первичных спиртов.
Алкоголяты представляют собой твёрдые вещества, растворимые в спирте. Они легко гидролизуются водой с образованием соответствующего спирта и щелочи:
C2H5ONa + H2O  C2H5OH + NaOH
C2H5OH + NaOH
2. Реакции замещения гидроксильной группы (реакции нуклеофильного замещения).
Спирты реагируют с газообразными галогеноводородами( в отсутствие воды), например:
C2H5OH + HBr  C2H5Br + H2O
C2H5Br + H2O