 |
|
Дегидратация (отщепление воды).
Нагревание спирта с концентрированной серной кислотой приводит к отщеплению воды и образованию алкена. Конкурирующим процессом является межмолекулярная дегидратация, в результате которой образуется простой эфир.
Прямая дегидратация спиртов под действием серной кислоты протекает с высоким выходом простого эфира только в случае первичных спиртов, например:
2С2Н5ОН  С2Н5 – О – С2Н5 + Н2О
С2Н5 – О – С2Н5 + Н2О
Вторичные и третичные спирты в этих условиях легко превращаются в алкены
Во многих случаях процесс дегидратации может привести к нескольким изомерам. Основной продукт образуется в соответствии с правилом Зайцева: в наибольшем количестве образуется алкен с наименьшим числом атомов водорода у двойной связи.
(CH3)2C(OH)CH2CH3  (CH3)2C = CHCH3 + H2O
(CH3)2C = CHCH3 + H2O
2-метилбутанол-2 бутен-2
Внутримолекулярная дегидратация преобладает при большом избытке серной кислоты и более сильном нагревании(t> 140оС), а межмолекулярная – при нагревании избытка спирта с серной кислотой( t< 140оС)
4. Этерификация (образование сложных эфиров).
Сложные эфиры образуются при действии на спирты минеральных или органических кислот.
С органическими кислотами реакция протекает в присутствии минеральных кислот(катализатор), например:
СН3СООН + С2Н5ОН = СН3СООС2Н5 + Н2О
Окисление спиртов
При окислении первичных спиртов на первой стадии образуются альдегиды, а на второй – карбоновые кислоты. Третичные спирты окисляются только с расщеплением углеродного скелета.
В качестве окислителя используются растворы перманганата калия и дихромата калия , концентрированная азотная кислота.
Для окисления первичных спиртов до альдегидов часто применяют метод пропускания паров спирта над раскалённым CuO.
Например: СН3СН2ОН + CuO(toC)  CH3CHO
CH3CHO
этанол этаналь
Окисление первичных спиртов в соответствующие карбоновые кислоты легко осуществляют, действуя концентрированной азотной кислотой или раствором перманганата калия.Например:
СН3СН2СН2ОН + (KMnO4 + H2SO4)  СН3СН2СООН
СН3СН2СООН
пропанол-1 пропановая кислота
Окисление вторичных спиртов в условиях, исключающих разрушение их углеродного скелета, приводит к получению кетонов:
СН3−СН(ОН) − СН3  СН3 − СО− СН3
СН3 − СО− СН3
пропанол-2 пропанон(ацетон)
Третичные спирты устойчивы к окислению в мягких условиях, например при использовании в качестве окислителя раствор CrO3 в трет-бутиловом спирте.
Однако в жёстких условиях происходит окислительная деструкция третичных спиртов, протекающая с разрывом связей С-С и приводящая к образованию смеси окисленных фрагментов молекулы в виде кетонов или карбоновых кислот:
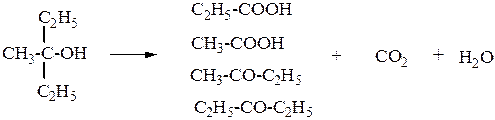
8.3. Многоатомные спирты
Многоатомные спирты способны к ассоциации в значительно большей степени, чем обычные, поскольку в их молекулах содержится большее число гидроксильных групп, участвующих в образовании водородных связей. Этим объясняется их хорошая растворимость в воде и существенно более высокие температуры кипения, чем в случае одноатомных спиртов с такой же молекулярной массой.
1.Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов.
Отличия:
2. При обработке хлоро- и бромоводородом замещение одной или двух гидроксильныхй групп на галоген происходит сравнительно легко.Последняя гидроксильная группа замещается значительно труднее – требуется применение соответствующих галогенидов фосфора:
HOCH2CH2OH + HCl(toC)  HOCH2CH2Cl + H2O
HOCH2CH2Cl + H2O
HOCH2CH2Cl + (PCl3)  ClCH2CH2Cl + POCl3 + HCl
ClCH2CH2Cl + POCl3 + HCl
Глицерин при обработке бромоводородом даёт в конечном итоге смесь двух изомерных дибромидов:
CH2(OH)CH(OH)CH2(OH) + HBr  CH2BrCHBrCH2(OH) +
CH2BrCHBrCH2(OH) +
CH2BrCH2(OH)CH2Br + H2O
3. По кислотности простейшие многоатомные спирты – этиленгликоль и глицерин – превосходят обычные.Многоатомные спирты реагируют с натрием. Этиленгликоль и глицерин, реагируя с натрием, дают мононатриевую соль. Дальнейшая реакция натрия с другими гидроксильными группами протекает в более жёстких условиях: (НО)СН2СН2(ОNa)
и [ СН2(ОNa)СН(ОН)СН2(ОН) + СН2(ОН)СН(ОNa)СН2(ОН) ].
4.Этиленгликоль и глицерин дают несколько рядов сложных эфиров в зависимости от того сколько гидроксильных групп участвовало в реакции этерификации. Например, глицерин даёт пять рядов сложных эфиров карбоновыхкислот:

При действии на глицерин нитрующей смеси(концентрированные азотная и серная кислоты) образуется полный сложный эфир глицерина и азотной кислоты – нитроглицерин – CH2(ONO2) – CH(ONO2) – CH2(ONO2).
5. Направление дегидратации этиленгликоля от условий её проведения. Так, в присутствии небольших количеств серной кислоты при нагревании происходит межмолекулярная реакция и образуется диоксан:

При нагревании с хлоридом цинка дегидратация происходит внутримолекулярно и приводит к уксусному альдегиду:
СН2(ОН)СН2(ОН)  СН3СНО
СН3СНО
При дегидратации глицерина (нагревание с бисульфатом калия ) отщепляется две молекулы воды и образуется непредельный альдегид –акролеин СН2=СНСНО.
6. Окислениеобычно приводит к образованию щавелевой(этандиовой)кислоты:
СН2(ОН) - СН2(ОН)  НООС-СООН
НООС-СООН
Окисление глицерина жёсткими окислителями(например, хромовая кислота) приводит к полному расщеплению молекулы. Мягкие окислители(например, разбавленная азотная кислота) в конечном счёте глицерин окисляют до глицериновой кислоты – СН2(ОН)- СН(ОН)- СООН.
7. Качественной реакцией на многоатомные спирты является взаимодействие с гидроксидом меди(II) в щелочной среде, приводящее к образованию внутрикомплексного соединения, имеющего интенсивную синюю окраску,например:

глицерин глицерат меди(II)
(синее окрашивание)
8.4.Примеры решения задач
Пример 24. При обработке 166г смеси пропанола и этанола металлическим натрием выделилось 33,6л(н.у.) водорода. Рассчитайте массовую долю спиртов в исходной смеси.
Решение:
1) Обозначим количество вещества пропанола через х , а количество вещества этанола через y. Тогда масса соответствующих спиртов будет:
m(C3H7OH) = 60x и m(C2H5OH) = 46y
Масса смеси спиртов равна: 60x + 46y = 166
2) Напишем соответствующие уравнения реакций:
2C3H7OH + 2Na  2C3H7ONa + H2
2C3H7ONa + H2
x 0,5x
2C2H5OH + 2Na  2C2H5ONa + H2
2C2H5ONa + H2
y 0,5y
3) Находим количество вещества водорода n(H2) = V(H2)/ VM = 33,6/22,4 = 1,5моль
4)Выражаем общее количество вещества водорода, выделившегося в результате реакции:
0,5x + 0,5y = 1,5 После преобразования получим: x + y = 3
5)Решаем систему двух уравнений с двумя неизвестными:
x + y = 3
60x + 46y = 166
Отсюда: x=2 и y=1
6) Тогда масса этанола равна 46∙1 =46г, а пропанола 60∙2 = 120г
Массовые доли спиртов в исходной смеси:
ω(С2H5OH) = 46/166 = 27,71% ω(C3H7OH) = 120/ 166 = 72,29%
Ответ:ω(С2H5OH) = 27,71% ω(C3H7OH) = 72,29%
Пример 25. При дегидратации предельного одноатомного спирта и последующем взаимодействии с бромом было получено 150,4г дибромида. При действии на такое же количество спирта избытком натрия выделяется 8,96л(н.у.) водорода. Каково строение исходного спирта?
Решение:
1)Напишем уравнения соответствующих реакций:
а)CkH2k+1OH  CkH2k + H2O
CkH2k + H2O
б)CkH2k + Br2  CkH2kBr2
CkH2kBr2
в)CkH2k+1OH + Na  CkH2k+1ONa + 0,5H2
CkH2k+1ONa + 0,5H2
2)Находим количество водорода:
n(H2) = V(H2)/VM = 8,96/22,4 = 0,4моль
3)Выражаем молярную массу дибромида как M = 14k + 160
и находим количества вещества дибромида:
n = m(дибромида)/ М(дибромида) = 150,4/ (14k + 160)
В соответствии с уравнениями а) и б) количество вещества дибромида равно количеству вещества спирта.
4)Так как n(CkH2k+1OH) = 2 n (H2)
150.4/(14k+ 160) = 2∙0,4 = 0,8; (14k + 160)∙0,8 = 150,4
11,2k + 128 = 150,4; k = 2
Исходный спирт: С2Н5ОН
Ответ: этанол
Пример 26. При обработке смеси стирола и этанола избытком натрия выделилось 4,48л(н.у.) газа. Такая же масса смеси полностью прореагировала с 200г 4% раствора брома в CCl4 . Определить массу исходной смеси.
Решение:
1) Запишем уравнения реакций:
а)C6H5CH=CH2 + Br2  C6H5CHBr – CH2Br
C6H5CHBr – CH2Br
б)2C:H5OH + 2Na  2C2H5ONa + H2
2C2H5ONa + H2
2) Находим количество вещества водорода: n(H2) = 4,48/22,4 = 0,2 моль
3) Находим массу брома: m(раствора)∙ ω(Br2) = 200∙0,04 = 8(г)
4) Количество вещества брома равно: 8/160 = 0,05(моль)
5) Согласно уравнению реакции (а)взаимодействия стирола с бромом количество вещества стирола равно количеству вещества брома
n(стир) = n(Br2) = 0,05моль.
Тогда масса стирола равна: m = M(стирола)∙n(стирола) = 104∙0,05 = 5,2(г),
6) Согласно уравнению реакции (б) n(C2H5OH) =2n(H2) и
масса этанола m(C2H5OH) = M(C2H5OH)∙n(C2H5OH) =46∙0,4 = 18,4(г)
7) Масса исходной смеси: m(стирол) + m(этанол) = 5,2 + 18,4 = 23,6(г).
Ответ:23,6 г
Пример27. При обработке 56,4г смеси этанола и пропандиола-1,2 избытком натрия выделился водород, в количестве достаточном для полного гидрирования 0,5 моль смеси этена и этина с плотностью по водороду 13,6. Определите состав исходной смеси в %% по массе.
Решение:
1)Запишем соответствующие уравнения реакций:
(1)
а)CH3−CH(OH) – CH2(OH) +2Na  CH3−CH(ONa) −CH2(ONa) + H2
CH3−CH(ONa) −CH2(ONa) + H2
б)2C2H5OH + 2Na  2C2H5ONa + H2 (2)
2C2H5ONa + H2 (2)
в)C2H4 + H2  C2H6 (3)
C2H6 (3)
г)C2H2 + 2H2  C2H6 (4)
C2H6 (4)
2) Рассчитываем среднюю молярную массу смеси газов:
Мср. (газ.смеси) =D(газ.смеси)водород ∙ М (Н2) = 13,6 ∙ 2 = 27,2 (г/моль).
3) Масса газовой смеси m = M(газ.смеси)∙ n(газ.смеси) = 27,2∙ 0,5 = 13,6(г)
4) Находим количества веществ этена и этина в газовой смеси:
m(смеси) = M(C2H4) n(C2H4) + M(C2H2) n(C2H2) ,
где n(C2H4) + n(C2H2) = 0,5
13,6 = 28 n(C2H4) + 26[0,5 - n(C2H4)]
Откуда n(C2H4) = 0,3 (моль) и n(C2H2) = 0,2(моль)
5) Согласно уравнениям (в) и (г) общее количество водорода равно
n(H2) = 0,3 + 0,4 = 0,7(моль)
Такое же количество водорода выделилось при взаимодействии спиртов с натрием.
6) Пусть n(пропандиол-1,2) =x (моль), а n(этанол) = y(моль).
Тогда согласно уравнениям (а) и (б):
x + 0,5y = 0,7
7) Масса смеси спиртов равна:
76x + 46y = 56,4
Решая систему двух уравнений с двумя неизвестными, находим x и y:

Отсюда: х=0,5 и y=0,4
Масса пропандиола –1,2 равна m1 = 0,5 ∙ 76 = 38(г)
Масса этанола равна m2 = 0,4∙ 46 = 18,4(г)
Массовая доля пропандиола –1,2 ω1 = 38/56,4 = 67,4%
Массовая доля этанола ω2 = 32,6%
Ответ: ω(этанола) = 32,6% ω(этандиола) = 67,4%