 |
|
Статистический смысл второго начала термодинамики.
Второе начало термодинамики связано с молекулярно-кинетической теорией строения вещества. Чтобы понять эту связь, рассмотрим простой пример. Пусть в сосуде находится всего четыре одинаковых молекулы, которые движутся хаотично. Мысленно разделим сосуд на две половинки: левую и правую. Вероятность нахождения каждой из молекул в той или иной половинке сосуда одинакова. Каждому состоянию данной системы соответствует какое-то распределение молекул между двумя половинками сосуда. Подсчитаем, каким числом способов молекулы могут распределиться в сосуде, присвоив каждой молекуле номер 1, 2, 3, 4 . Результат представим в виде таблицы:
| Состояние системы | Половинки сосуда левая правая | Число способов реализации состояния | |
| “4+0” | 1 2 3 4 | 1 2 3 4 | |
| “3+1” | 1 2 3 1 2 4 1 3 4 2 3 4 | 1 2 3 1 2 4 1 3 4 2 3 4 | |
| “2+2” |
Общее число способов реализации состояния равно 16. Таким образом, вероятность реализации каждого из состояний равна 1/16, т. к. все состояния равновероятны.
Поскольку все молекулы одинаковы, для характеристики термодинамического состояния системы неважно, каковы номера молекул. Важно, сколько молекул содержится в каждой из половинок сосуда. Для характеристики вероятности каждого состояния вводится так называемая термодинамическая вероятностьP, равная числу различных способов, которыми может быть реализовано данное термодинамическое состояние. В рассмотренном примере для состояния “4+0” P=2, для состояния “3+1” P=8, для состояния “2+2” P=6. Таким образом, наибольшей термодинамической вероятностью обладают состояния “3+1” и “2+2”. Очевидно, что если систему предоставить самой себе, то она будет переходить в более вероятное состояние. Одновременно будет возрастать и энтропия системы. Поэтому можно предположить, что между ними существует связь. Такая связь действительно есть и имеет, как показал Больцман, вид
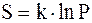 ,
,
где k - постоянная Больцмана.
При увеличении числа частиц вероятность того, что все они соберутся в одной половине сосуда резко падает. Поэтому для реальных систем, она оказывается ничтожно малой. Следовательно, самопроизвольный переход системы в состояние, когда все молекулы соберутся в одной половине сосуда, маловероятен. Самопроизвольно будут протекать лишь процессы, идущие в направлении увеличения термодинамической вероятности и, соответственно, увеличения энтропии.
В равновесном состоянии системы из большого числа молекул наиболее вероятным является равномерное распределение их по объему, что соответствует одинаковой концентрации молекул во всех частях сосуда. Но возможны и отклонения от равномерного распределения, называемые флуктуациями, когда в какой-то части концентрация становится больше или меньше среднего значения. Особенно заметны флуктуации в системах состоящих из небольшого числа частиц, например, в разреженных газах.
С учетом вышеизложенного формулировка второго начала термодинамики должна быть уточнена: в замкнутой макроскопической системе наиболее вероятным является процесс, сопровождающийся возрастанием энтропии.