 |
|
Математическое дополнение.
1. Вывод распределения Гаусса.
Возьмём в качестве исходного, биномиальное распределение
 (1)
(1)
Прологарифмируем  +
+  (2)
(2)
Значение m=  ,при котором P достигает максимума найдём из условия:
,при котором P достигает максимума найдём из условия:
 =0 или
=0 или  = 0 =
= 0 =  (3)
(3)
При этом для каждого факториала воспользуемся приближением  Дифференцируя (2):
Дифференцируя (2):  C учётом, что p+q=1, найдем значение m=
C учётом, что p+q=1, найдем значение m=  :
: 
Для получения компактной записи функции распределения, разложим lnP в окрестности  в ряд Тейлора. Свойства этого разложения таковы, что члены ряда быстро убывают и можно ограничиться первыми членами разложения.
в ряд Тейлора. Свойства этого разложения таковы, что члены ряда быстро убывают и можно ограничиться первыми членами разложения.
 ](m-
](m-  (4)
(4)
Так как первая производная от lnP равна нулю при m=  (3), то ограничим ряд только вторым членом:
(3), то ограничим ряд только вторым членом:

Вторую производную легко вычислить из (3):  =
= 
В точке  Вторая производная
Вторая производная 
Разложение (4) примет вид: 
 (5)
(5)
Величина (постоянная)  :
:

Последний интеграл сводится к табличному : 

 Полагая
Полагая  , и
, и  , получим распределение Гаусса:
, получим распределение Гаусса:
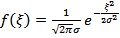 .
.
2. Статистический смысл энтропии (полный вывод).
Пусть изолированная термодинамическая система  находится в состоянии с энергией
находится в состоянии с энергией  . Это состояние равновероятно реализуется
. Это состояние равновероятно реализуется  способами. Разобьём условно систему
способами. Разобьём условно систему  на две подсистемы
на две подсистемы 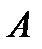 и
и  , таких, что гамильтонианы систем связаны соотношением:
, таких, что гамильтонианы систем связаны соотношением:  Положим далее, что внешние силовые поля отсутствуют и элементы подсистем не взаимодействуют между собой, но могут обмениваться энергией. Для изолированной системы
Положим далее, что внешние силовые поля отсутствуют и элементы подсистем не взаимодействуют между собой, но могут обмениваться энергией. Для изолированной системы  выполняется закон сохранения энергии: сумма энергий подсистем равна энергии сложной системы:
выполняется закон сохранения энергии: сумма энергий подсистем равна энергии сложной системы:  . Пусть число доступных состояний
. Пусть число доступных состояний  и
и  подсистем А и А1 соответствует случаям, когда их энергии лежат , соответственно, в интервалах Е,
подсистем А и А1 соответствует случаям, когда их энергии лежат , соответственно, в интервалах Е,
Е+ δЕ и Е1, Е1+δЕ1. Найдём вероятность того, что из общего числа состояний 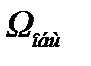 системы А0 , часть
системы А0 , часть  соответствует состоянию подсистемы А с энергией Е. По определению вероятности:
соответствует состоянию подсистемы А с энергией Е. По определению вероятности:
 (11)
(11)
то есть вероятность пропорциональна числу доступных состояний.
В тоже время каждое из состояний  подсистемы А с энергией Е можно комбинировать с любым доступным состоянием подсистемы
подсистемы А с энергией Е можно комбинировать с любым доступным состоянием подсистемы  с энергией
с энергией  . Тогда полное число доступных состояний системы
. Тогда полное число доступных состояний системы  , в которых энергия подсистемы
, в которых энергия подсистемы  равна
равна  , будет выражаться произведением:
, будет выражаться произведением:
 (12)
(12)
( так как произведение вероятностей пропорционально произведению числа доступных состояний). С учётом (12) соотношение (11) примет вид  (13)
(13)
Воспользуемся каноническим распределением Гиббса и связью вероятности с плотностью распределения вероятности
 (14)
(14)
где  - плотность распределения вероятности.
- плотность распределения вероятности.
 (15)
(15)
Интегрируя (14), с учётом (15) и  получим искомую вероятность:
получим искомую вероятность:
 (16)
(16)
Здесь D - некоторый параметр, который переходит в постоянную величину в равновесном состоянии системы  . Найдём условия перехода системы
. Найдём условия перехода системы  и её подсистем в равновесное состояние.
и её подсистем в равновесное состояние.
Равновесное состояние системы характеризуется максимальной вероятностью или максимальным числом доступных состояний. Для нахождения условий равновесного перехода исследуем на максимум: 
Заметим, что производная от логарифма вероятности по энергии 
равна нулю в тех же точках, что и производная от вероятности.
Так как D не зависит от энергии, то  (17)
(17)
Равенство (17) показывает, что равновесное состояние системы  наступит тогда и только тогда, когда параметры Т и
наступит тогда и только тогда, когда параметры Т и  подсистем А и
подсистем А и  станут равными соответствующему параметру
станут равными соответствующему параметру  системы
системы  . Этот параметр - абсолютная температура.
. Этот параметр - абсолютная температура.
Поскольку абсолютная температура всегда только положительная величина, то в процессе перехода в равновесное состояние должно выполняется условие .
Введём некоторую функцию, которая могла бы указывать направление передачи энергии в процессе перехода системы в равновесное состояние. Прологарифмируем (13) и приравняем нулю производную по энергии.
 (18)
(18)
При выводе (18) учтено, что  Выделим из соотношений (18) равенство:
Выделим из соотношений (18) равенство:

Преобразуем последнее выражение к виду:  (19)
(19)
Для анализируемой термодинамической системы левая часть равна нулю в тех же точках, что и производная от вероятности.
Так как D не зависит от энергии, то  (17)
(17)
Равенство (17) показывает, что равновесное состояние системы  наступит тогда и только тогда, когда параметры Т и
наступит тогда и только тогда, когда параметры Т и  подсистем А и
подсистем А и  станут равными соответствующему параметру
станут равными соответствующему параметру  системы
системы  . Этот параметр - абсолютная температура.
. Этот параметр - абсолютная температура.
Поскольку абсолютная температура всегда только положительная величина, то в процессе перехода в равновесное состояние должно выполняется условие .
Введём некоторую функцию, которая могла бы указывать направление передачи энергии в процессе перехода системы в равновесное состояние. Прологарифмируем (13) и приравняем нулю производную по энергии.  (18)
(18)
При выводе (18) учтено, что  Выделим из соотношений (18) равенство:
Выделим из соотношений (18) равенство:
. 
Преобразуем последнее выражение к виду:  (19)
(19)
Для анализируемой термодинамической системы левая часть представляет собой разность приведённых теплот, которыми обмениваются подсистемы А и  . Правая часть должна быть равна по определениям классической молекулярной физики разности дифференциалов энтропий этих подсистем. Следовательно:
. Правая часть должна быть равна по определениям классической молекулярной физики разности дифференциалов энтропий этих подсистем. Следовательно:  Это и есть статистическое определение энтропии термодинамической системы, введённое М.Планком.
Это и есть статистическое определение энтропии термодинамической системы, введённое М.Планком.
Теперь (19) можно переписать в виде:
Полагая, что по прежнему Т1 >Т, в правой части тогда dS > dS1 , то есть подсистема А получает тепло, а подсистема А1 его отдаёт. В изолированной системе поток тепловой энергии направлен от подсистемы с большей температурой к подсистеме с более низкой температурой. Исходя из аддитивности энтропии, можно утверждать, что энтропия изолированной термодинамической системы не убывает.
 (20) Неравенство (20) представляет собой второе начало термодинамики в энтропийной формулировке.
(20) Неравенство (20) представляет собой второе начало термодинамики в энтропийной формулировке.
Программа курса физики.. КНиИТ, 1 курс ,2 семестр.
МЕХАНИКА
Раздел 1. Введение.
Математический аппарат физики. Векторы и операции с ними.
Раздел 2. Кинематика.
Материальная точка. Системы отсчета. Траектория. Перемещение и путь. Скорость и ускорение. Тангенциальное и нормальное ускорения. Классификация движения по ускорению. Кинематика прямолинейного и вращательного движений точки. Кинематика колебательного и волнового движений. Примеры, практические задачи.
Движение твёрдого тела. Степени свободы. Поступательное и вращательное движение твёрдого тела. Теорема Эйлера о произвольном движение твёрдого тела.
Раздел 3. Законы динамики.
Основная задача динамики. Первый закон Ньютона. Инерциальные системы отсчета. Взаимодействие тел. Сила. Масса и импульс тела. Второй закон Ньютона, и его особенности. Третий закон Ньютона и границы его применимости.
Твёрдое тело. Момент импульса, момент силы, момент инерции. Уравнение моментов - дифференциальное уравнение движения твёрдого тела. Уравнения динамики колебательного и волнового движений (волновое уравнение). Примеры, практические задачи.
Раздел 4. Законы сохранения.
Закон сохранения импульса и его особенности. Закон сохранения момента импульса. Примеры: распад нейтрона, движение планет солнечной системы, гироскоп.
Работа сил. Потенциальная и кинетическая энергия. Работа и энергия вращения Закон сохранения механической энергии. Примеры, практические задачи.
Раздел 5. Гравитационное поле.
Закон всемирного тяготения. Гравитационное поле. Гравитационная энергия. Гравитационный радиус. «Чёрные дыры» Движение в поле тяготения Земли. Космические скорости.
Раздел 6. Движение в неинерциальных системах отсчёта.
Силы инерции в общем случае. Поступательные и центробежные силы инерции. Сила Кориолиса. Проявления сил инерции в движениях на Земле.
Раздел 7. Элементы теории относительности. Примеры
МОЛЕКУЛЯРНАЯ СТАТИСТИЧЕСКАЯ ФИЗИКА.
Раздел 1. Введение.
Предмет и методы молекулярной физики и термодинамики. Развитие представлений о строении вещества. Молекулярно-тепловое движение. Межмолекулярные силы. Равновесное состояние термодинамической системы. Температура.
Раздел 2. Динамическая теория идеального газа.
2.1. Давление и средняя энергия молекул газа. Основное уравнение молекулярно-кинетической теории идеального газа. Изопроцессы.
2.2. Столкновения молекул. Средняя длина свободного пробега. Явления переноса в газах: диффузия, внутреннее трение, теплопроводность.
Раздел 3. Основы статистического описания термодинамических систем. .
3.1.Основные понятия. Микро- и макропараметры состояния. Равновесные состояние системы. Понятие фазового пространства и его свойства..
3.2. Элементы теории вероятностей. Случайные величины и их описание. Функция распределения. Средние значения, математическое ожидание, дисперсия и флуктуации. Биноминальное распределение. Распределение в системах с большим количеством элементов Распределение Пуассона и Гаусса.
3.3. Статистические распределения для идеального газа.
Координата и скорость молекулы как случайные величины. Фазовое пространство координат и импульсов, обобщённые координаты. Функция Гамильтона. Каноническое распределение Гиббса. Распределение молекул по скоростям Максвелла. Закон распределения энергии по степеням свободы. Термодинамическая система в поле внешних сил. Идеальный газ в гравитационном поле, распределение Максвелла- Больцмана .
Раздел 4..Элементы статистической термодинамики
4.1. Основные положения статистической термодинамики. Условия равновесия.. Начала термодинамики.
4.2. Термодинамические процессы. Превращение тепла в работу. Циклические процессы. Энтропия и энергия. «Энтропийная» формулировка второго начала термодинамики. Энтропия и вероятность, статистический смысл энтропии. Парадокс Максвелла. Информационный смысл энтропии
ПЕРЕЧЕНЬ ОСНОВНОЙ И ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
1. Савельев И.В. Курс общей физики. Т. 1, 2, . - М.: Наука, 1980.
2. Сивухин Д.В. Общий курс физики. Т. 1,2. М., 1974-1980.
3. Стратонович Р.Л, Поляков М.С.. Элементы молекулярной физики, термодинамики и статистической физики. Изд. МГУ,1981.
4. Ф. Рейф. Статистическая физика. ВКФ. Изд. «Наука», М.,1977.