 |
|
Скорость лимитирующая стадия реакции — образование s-комплекса.
Реакционная способность алкенов
I. Реакции электрофильного присоединения (АЕ)
Таблица 1
| Название реакции | Субстрат | Реагент | Катализатор | Электрофильная частица | Карбокатион | Продукт реакции |
| Гидрирование | СН3 – СН = СН2 | Н2 | Рt, Ni | 
| 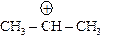
| СН3 – СН2 – СН3 пропан |
| Галогенирование | СН3 – CH = CH2 | Br2 (Гал2) | 
| 
|  1, 2-дибромпропан
1, 2-дибромпропан
| |
 Гидрогалогенирование Гидрогалогенирование
| СН3 – CH = CH2 | НСI (HBr) | 
| 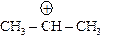
|  2-хлорпропан
2-хлорпропан
| |
| Гидратация | СН3 – СН = СН2 | 
|  (Н2SO4)
(Н2SO4)
| 
| 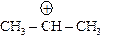
|  пропанол-2
пропанол-2
|
II. Окисление алкенов

III. Полимеризация алкенов

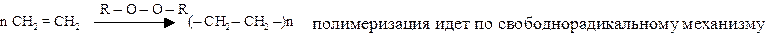
 |
Реакции электрофильного замещения (SE) у аренов
Таблица 2
| Название реакции | Субстрат | Реагент | Катализатор | Генерирование электрофильной частицы | Электрофильная частица | Продукт реакции |
| Галогенирование | 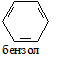
| Вr2 (CI2) | FeBr3 (AICI3) | 
| 
| 
|
| Алкилирование | 
| CH3CI | AICI3 | 
| CH3+ | 
|

| CH3 – CH = CH2 | Н+ | 
| 
| 
| |

| Н+ | 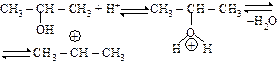
| 
| 
| ||
| Ацилирование | 
| 
| AICI3 | 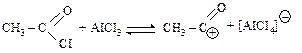 ацетилхлорид ацетилхлорид
| 
| 
|
| Нитрование | 
| НNО3 | Н2SO4 | 
| 
| 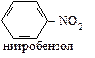
|
| Сульфирование | 
| SO3 H2SO4 | H2SO4 | 
| 
| 
|

РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ
ПО КРАТНЫМ СВЯЗЯМ (АЕ)
Эти реакции характерны для соединений, содержащих изолированные или сопряженные p-связи: алкенов, алкадиенов, ароматических и гетероциклических соединений в особых условиях; гетерофункциональных соединений, содержащих в углеводородной цепи двойные связи. У диеновых углеводородов и аренов в результате делокализации электронов увеличивается энергия активации и возрастает необходимость в использовании катализаторов.

При действии электрофильного реагента на изолированную двойную связь происходит разрыв менее прочной p-связи, и результатом реакции является присоединение. Реакция протекает стадийно через образование p- и s-комплексов:

Скорость лимитирующая стадия реакции — образование s-комплекса.
Реакции галогенирования. Алкены в обычных условиях легко взаимодействуют
с галогенами. Например, при действии бромной воды на непредельные соединения, происходит быстрое обесцвечивание бромной воды, поэтому эта реакция является качественной на непредельность соединения.

Скорость присоединения галогенов к алкенам существенно зависит от строения алкена. При введении в алкен электронодонорных заместителей за счет их +I эффекта увеличивается электронная плотность между атомами углерода, связанными двойной связью, и скорость реакции возрастает. Напротив, электроноакцепторы, вследствие –I понижают электронную плотность в алкене и затрудняют электрофильную атаку.

Реакции гидрогалогенирования. Правило Марковникова.Рассмотрим реакцию взаимодействия пропена (несимметричный алкен) с хлороводородом:

 В соответствии с эмпирическим правилом Марковникова
В соответствии с эмпирическим правилом Марковникова
водород присоединится к наиболее гидрированному атому углерода, а галоген к наименее гидрированному, т. е. реакция приводит к одному из двух возможных изомерных продуктов присоединения (региоселективная реакция). В исходном алкене p-связь поляризована за счет +ICH3. В результате на первом углеродном атоме возникает избыточная электронная плотность, что будет облегчать атаку электрофила именно по этому углеродному атому (статический фактор). При атаке на p-связь электрофила (Н+ ) возможно образование двух карбокатионов, причем более устойчивым будет вторичный, так как две метильные группы, обладающие +I СН3, лучше компенсируют положительный заряд, чем одна этильная группа (динамический фактор.
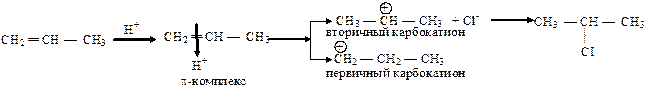
Таким образом, поскольку химические реакции имеют тенденцию идти в направлении образования более стабильных частиц, то оба фактора действуют согласованно, что и приводит к образованию 2-хлорпропана. Если статический и динамический факторы противоположны, доминирует динамический фактор. Следовательно, в настоящее время правило Марковникова имеет следующую интерпретацию: направление присоединения реагентов типа НХ к непредельным соединениям определяется относительной устойчивостью промежуточно образующихся карбокатионов.
Правило Марковникова соблюдается даже в том случае, если в алкене вместо метильной группы имеется электроноакцепторный атом галогена, например, в винилхлориде:
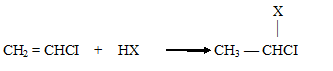
Следует отметить, однако, что с данным соединением реакция протекает с большим трудом. Объяснение данного факта состоит в том, что следует учитывать не только большой отрицательный индуктивный эффект атома хлора, снижающий реакционную способность алкена, но и положительный мезомерный эффект (+М), обусловленный наличием у атомов галогенов неподеленных пар р-электронов:

Могут образоваться в качестве промежуточных продуктов два карбокатиона — I и II. Реакция предпочтительно протекает с образованием карбокатиона I, потому что в нем в рассредоточении положительного заряда участвует также и атом галогена.
При присоединении галогеноводородов к несимметричным алкенам, у которых оба атома углерода, образующие двойную связь, связаны с равным числом водородных атомов, водород присоединяется к атому углерода, связанному с большим алкильным остатком
(эмпирическое правило Зайцева–Вагнера):

Причиной такого направления реакции также является образование более устойчивого промежуточного карбокатиона.

Реакция гидратации является одной из биологически важных реакций АЕ, поскольку протекает с непредельными соединениями in vivo. Молекула воды является нуклеофильным реагентом, поэтому реакция нуждается в кислотном катализе. Кислота является источником электрофила — Н+. Если в реакцию гидратации вступают несимметричные алкены, то присоединение идет с учетом правила Марковникова.

Если в несимметричном алкене имеется электроноакцептор, или реакция идет по свободно-радикальному механизму (пероксидный эффект Караша), присоединение может идти с нарушением правила Марковникова:

В случае, если присоединение НХ к алкенам проводится в присутствии кислорода, пероксидов и других инициаторов радикальных процессов, то реакция протекает по свободно-радикальному механизму, происходит гомолитическое расщепление НВr:
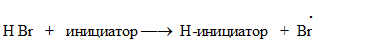


Реакция окисления алкенов (реакция Вагнера) — взаимодействие непредельных соединений с водным раствором КМnО4. Эта реакция также является качественной на непредельность соединения, так как в результате происходит обесцвечивание раствора КМnО4 или образование бурого осадка МnО2. В результате реакции из алкена образуется продукт цис-присоединения — двухатомный спирт.

У алкадиенов с сопряженными двойными связями реакция АЕ протекает в двух направлениях: 1,4- (80 %) и 1,2-присоединение (20 %).


Преимущественное образование продукта присоединения в положении 1 и 4 объясняется тем, что образующийся карбокатион I переходит в более устойчивый карбокатион II,
в котором частичный отрицательный заряд на атоме брома и положительный заряд на атоме углерода находятся на концах иона. Более стабильный карбокатион II далее быстро подвергается атаке нуклеофила, что и приводит к образованию 1,4-дибромбутена-2.