 |
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Бийский технологический институт (филиал)
Н. В.Степанова
ПОТЕНЦИОМЕТРИЯ
Методические рекомендации к выполнению лабораторных
работ по курсу «Аналитическая химия и физико-химические методы анализа» для студентов специальностей 240701, 240702, 240901, 260204 и «Физико-химические методы потребительских товаров» для специальности 080401 всех форм обучения
Бийск
Издательство Алтайского государственного технического
университета им. И.И.Ползунова
УДК 543. 06(075.8)
Разработано в соответствии с государственным образовательным стандартом ВПО по направлению подготовки дипломированных специалистовспециальностей «Химическая технология органических соединений азота» (240701), «Химическая технология полимерных композиций, порохов и твёрдых ракетных топлив (240702), «Биотехнология» (240901), «Технология бродильных производств и виноделие» (260204), «Товароведение и экспертиза товаров» (080401) в соответствии с требованиями Государственных образовательных стандартов высшего профессионального образования (Москва, 2000 г.) на основе рабочей программы дисциплины «Аналитическая химия и физико-химические методы анализа».
Рецензент: профессор, кандидат химических наук Ю. В. Мороженко
Работа подготовлена на кафедре общей химии и экспертизы товаров
Степанова, Н.В. Потенциометрия: методические рекомендации к выполнению лабораторной работы по курсу «Аналитическая химия и физико-химические методы анализа» для студентов специальностей 240701, 240702, 240901, 260204 и «Физико-химические методы потребительских товаров» для специальности 080401 всех форм обучения / Н.В. Степанова − Алт. гос. техн. ун-т БТИ. – Бийск: Изд-во Алт. гос. техн. ун-та, 2010. – с.
УДК 543. 06(075.8)
Рассмотрены и одобрены на заседании научно-методического совета Бийского технологического института
Протокол № от 2010 г
| © Н. В. Степанова Н.В. 2010 © БТИ АлтГТУ, 2010 |
Содержание
| 1 Теоретическая часть………………………………………………….. |
| 1. 1 Теоретические основы метода потенциометрии………………… |
| 1. 2 Электроды, используемые в потенциометрии |
| 1. 3 Метод потенциометрического анализа |
| 1. 4 Графические способы определения точки эквивалентности при титровании |
| 2 Экспериментальная часть |
| 2. 1 Лабораторная работа «Определение объёма кислоты в её растворе методом потенциометрического титрования» |
| 3 Вопросы для защиты работы………………………………………… |
| 4 Техника безопасности………………………………………………... |
| Литература……………………………………………………………… |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1. 1 Теоретические основы метода потенциометрии
В основе потенциометрических измерений лежит зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона.
При этом потенциал одного из электродов, который называется индикаторным, зависит от концентрации определяемого компонента. Потенциал другого электрода, который называется стандартным или электродом сравнения, не зависит от концентрации определяемого компонента и остаётся постоянным. Реальные потенциалы электродов (φ) можно рассчитать по уравнению Нернста:
φ = φ0 +  , (1)
, (1)
где φ0 – стандартный потенциал редокс─системы, мв;
n – число электронов, принимающих участие в электродной реакции;
[ок] – концентрация окисленной формы; моль/л;
[вос] – концентрация восстановленной формы; моль/л;
Метрологические характеристики метода потенциометрии таковы: чувствительность до 10-5 моль/дм3; точность прямых методов 2…10%, косвенных – 0,5…1%, воспроизводимость ± 5%.
1. 2 Электроды, используемые в потенциометрии
Электроды, которые используются в потенциометрии, можно разделить на несколько видов.
Электроды первого родаобратимы относительно ионов металла, из котороговыполнен электрод.Различают активные и инертные металлические электроды. Активные металлические электроды изготовляют из металлов, образующих восстановленную форму обратимой окислительно-восстановительной системы (Ag, Pb, Cu, Cd). Потенциал такого электрода является функцией активности собственных ионов в растворе, например для серебряного индикаторного электрода ( Ag+ + е ®Ag).
Если металлический электрод опустить в раствор соли этого металла, то образуется окислительно-восстановительная пара Меn+/Ме, потенциал которого можно измерить на потенциометре, а концентрацию (активность) металла можно рассчитать по уравнению Нернста:
φ = φ0 +  , (2)
, (2)
где [Меn+] – активность ионов металла, моль/л.
Электроды второго рода чувствительны к изменению концентрации (активности) анионов в растворе и представляют собой металл, покрытый слоем нерастворимой соли металла с анионом (А-), к которому чувствителен электрод. При соприкосновении такого электрода с раствором, содержащим анион А-, возникает потенциал, который зависит от произведения растворимости соли и концентрации аниона:
φ = φ0Ме+/Ме +  , (3)
, (3)
где [A-] – активность аниона А, моль/л.
К электродам второго рода относятся хлорсеребряный, каломельный электрод и другие.
Для определения концентрации (активности) ионов в растворе необходимо измерить электрохимический потенциал индикаторного электрода, погружённого в исследуемый раствор, относительно электрода сравнения.
Электродом сравнения называют электрод с известной и постоянной величиной электродного потенциала. Обычно в качестве электродов сравнения используют каломельный или хлоридсеребряный (хлорсеребряный) электрод.
Основной частью хлорсеребряного элект рода является погружённая в насыщенны раствор KCl серебряная проволока, покрытая слоем AgCl (рисунок 1).Контакт электрода с раствором осуществ-ляется через мостик из асбестовой нити, смоченной раствором KCl, с потенциометром – через серебряную проволоку.
Стандартный потенциал хлорсеребрянного электрода равен 0,22 В, каломельного электрода в насыщенном растворе KCl равен 0, 246 В, а в растворе KCl, концентрация которого 1 моль/дм3, – 0,280 В.
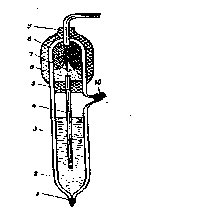
1─нить асбестовая; 2─корпус; 3─насыщенный раствор КCl; 4─электроли-тический ключ; 5, 8─резиновые пробки; 6─полость; 7─контактный полуэлемент; 9─колпачок; 10─пробка.
Рисунок 1-Хлорсеребряный электрод (типа ЭВЛ-1 МТ)
Индикаторным электродом или электродом определения называют электрод, который обратим относительно активности анализируемого потенциалопределяющего иона. В качестве индикаторных электродов в последние годы используются ионселективные мембранные электроды.
Мембранные или ионоселективные электроды имеют мембрану, на которой возникает мембранный потенциал. Величина потенциала зависит от разности концентраций одного и того же иона по разные стороны мембраны. По материалу мембраны электроды подразделяются: стеклянные электроды, электроды с жидкими мембранами, электроды с твёрдыми или осадочными мембранами, электроды с газочувствительными мембранами. Широкое применение для определения кислотности нашёл такой мембранный электрод, как стеклянный (рисунок 2).
Стеклянные мембраны изготовляют из специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определенному иону и позволяла определять его в присутствии других.

1—стеклянная рН—чувствительная мембрана; 2—-0,1М раствор НС1; 3—-серебряная проволока, покрытая AgCl; 4—-стеклянная трубка; 5—изоляция; 6—токоотвод.
Рисунок 2—Стеклянный электрод для измерения рН
1. 3 Метод потенциометрического анализа
Потенциометрический анализ может быть выполнен как прямым, так и косвенным методом (метод потенциометрического титрования). В прямом методе измеряют реальный потенциал раствора, а затем по уравнению Нернста рассчитывают концентрацию раствора. При косвенном методе проводят потенциометрическое титрование определяемого вещества подходящим титрантом. При этом можно проводить как прямое, так и обратное титрование. По кривым титрования определяют объём титранта, затраченного на титрование, который подставляют в расчётные формулы, используемые в титриметрических методах анализа. Потенциометрическое титрование благодаря своим широким возможностям используется чаще.
Результаты измерений методом потенциометрического титрования более точны, чем при использовании метода прямой потенциометрии, так как в этом случае вблизи точки эквивалентности небольшому изменению концентрации соответствует большое изменение потенциала индикаторного электрода. В ходе титрования измеряют и записывают значение потенциала ячейки после добавления каждой порции титранта.
Потенциометрическое титрование можно проводить, используя реакции нейтрализации, окисления-восстановления, осаждения или комплексообразования. В методе кислотно-основного титрования подбирают индикаторный электрод, потенциал которого зависит от рН раствора. Таких электродов несколько: водородный, хингидронный, сурьмяный, однако наиболее широкое применение нашёл стеклянный электрод. При осадительном титровании в качестве индикаторного электрода используют металл, составляющий электродную пару с определяемым ионами. Например, при титровании серебра растворами галогенидов можно использовать в качестве индикаторного электрода серебряный электрод. При комплексонометрическом титровании индикаторным электродом может служить либо металлический электрод, обратимый к определяемым ионам металла, либо платиновый электрод, если в растворе присутствует окислительно-восстановительная пара: Fe3+/ Fe2+, Cu2+/ Cu+, Co3+/Co2+.
При окислительно-восстановительном титровании в качестве индикаторного электрода чаще всего используют платиновый электрод.