 |
|
Методические указания
Полярографический метод исследования электрохимических систем впервые был предложен чешским ученым Ярославом Гейровским в 1922 г. Метод основан на зависимости характера поляризации рабочего электрода и состава раствора, в котором он находится. Термин « полярография» означает « запись процесса поляризации».
Поляризацией электрода называется процесс изменения значения равновесного потенциала при прохождении через него постоянного тока.
Исходя из уравнения Нернста, это изменение может произойти из-за:
1) изменения нормального электродного потенциала Е0 ( первый член уравнения);
2) изменения концентрации С потенциалопределяющих ионов в приэлектродном слое и растворе ( второй член уравнения).
Первый случай возможен только при изменении материала электрода; такой вид поляризации называется химической, или электродной.
Поляризация во втором случае называется концентрационной и применяется для качественного и количественного анализа растворов электролитов.
Графическая запись процесса концентрационной поляризации называется полярограммой. Она строится в координатах ток – напряжение, т.е. является по сути вольт-амперной характеристикой (рис.1). Параметры полярограммы позволяют определить качественные и количественные характеристики исследуемого раствора: катионы каких металлов и в каком количестве находятся в растворе или расплаве.
Область применения полярографии очень широкая:
как инструмент исследования кинетики электрохимических и химических процессов; процессов адсорбции и комплексообразования; для автоматического контроля в производстве полимеров, полупроводников, редкоземельных элементов и их соединений, пищевых продуктов, в медицине, биологии и в фармацевтике для очень тонких определений содержания гормонов, витаминов и других веществ.
Достоинства метода:
высокая чувствительность ( порог чувствительности составляет 0,00001…0,000001 кмоль/м3 );
быстродействие ( несколько минут);
высокая точность ( относительная погрешность не более 5%);
возможность одновременного установления качественного и количественного состава пробы;
возможность многократного определения одной и той же пробы.

 1
1
 2
2

 5
5
 |
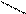 9
9
Рис. 2. Принципиальная схема полярографа Гейровского
Схема прибора для снятия и изучения поляризационных кривых, впервые предложенная Я. Гейровским, представлена на рис. 2. В качестве поляризующегося микроэлектрода был применен ртутный капельный электрод, состоящий из воронки (груши) 1 и капилляра 2. В воронку со ртутью вводился контактный провод, соединенный через реостат 3 с источником постоянного тока (аккумулятора) 4. Вторым электродом (анодом) служил слой ртути, налитый на дно электролитической ячейки 5 ( ртутное «дно»). Электрохимический процесс происходит на поверхности ртутной капли 6 за время, пока капля во взвешенном состоянии (« время жизни» капли). Для измерения поляризующего напряжения и диффузионного тока применяются вольтметр 7, реохорд 8 и амперметр 9.
Электродный процесс – это совокупность изменений, происходящих в растворе и на поверхности электрода в результате прохождения постоянного тока при непрерывно изменяющемся потенциале, отличном от равновесного. В процессе можно условно выделить три стадии:
1) доставка ионов или молекул вещества из общей массы раствора к поверхности электрода ( диффузия);
2) электровосстановление или электроокисление (собственно электрохимический процесс);
3) образование новой фазы, удаление вещества с поверхности электрода.
Скорость всего процесса зависит от скорости самой медленной стадии. В данном случае она лимитируется (определяется) скоростью доставки
(диффузии) вещества и зависит от перепада концентраций в растворе и приэлектродном диффузионном слое[[[[ [1]:
V= K • (Co – Cэ ), (1)
Где К = D / L ( D – коэффициент диффузии, L – толщина диффузионного слоя); Со – концентрация в толще раствора;
Сэ – концентрация ионов в приэлектродном диффузионном слое;
В то же время скорость диффузии (кг–ион/ с × м 2 ) – это количество вещества, поступившее в единицу времени (n) на единицу площади поверхности электрода(S):
V = n / S (2)
В ходе электрохимического процесса, например, восстановления металла на поверхности электрода, будет происходить обеднение ионами металла диффузионного слоя, разность концентраций увеличится, что вызовет увеличение скорости диффузии V. В какой-то момент (стационарный режим) наступит динамическое равновесие между процессом « доставки» и процессом восстановления металла на катоде, т.е. скорости этих процессов уравняются:
n/S = K• (Co – Cэ ) = D/ L • (Co – Cэ ) (3)
По закону Фарадея плотность тока? проходящего через электролитическую ячейку равна, (А/ м):
Is = F• n •z / S = I / S, (4)
где F - число Фарадея, численно равное количеству электричества, необходимого для выделения одного килограмм-эквивалента вещества, z - валентность металла.
Подставляя значение n /S из уравнения (3), получим значение плотности тока, А/м2:
Is = F• z • D • ( Co – Cэ) / L = F•z•D• Co /L – F•z•D • Cэ/L (5)
При концентрации ионов в приэлектродном слое Сэ, равной нулю, имеем максимальную ( предельную) плотность тока ( Is ), которую можно достичь при разряде на электроде ионов данного вида при данной концентрации их в растворе Со. Соответствующий этой предельной плотности ток называется предельным диффузионным током Id и равен соответственно:
Id = z •F•D•S (6)
Умножив оба члена уравнения (5) на S и, домножив второй член уравнения на величину Со/Со, перейдем от значения плотности тока к общему значению токаI:
I = Is • S = Id • (1 - Cэ/Со) (7)
Отсюда следует, что сила тока при постоянной толщине диффузионного слоя пропорциональна концентрации данного иона в электролите;
при концентрации ионов в приэлектродном слое равной Со, величина диффузионного тока равна нулю ( при Сэ = Со, I =0 );
при Cэ = 0 величина диффузионного тока достигает предельного значения
( I = Id).
На практике используется понятие среднего диффузионного тока Im, равного половине предельного значения диффузионного тока (Im = 0,5 Id ).
Уравнение Ильковича устанавливает зависимость сила диффузионного тока от концентрации разряжающегося иона у поверхности электрода и в общем объеме раствора, а также от ряда других факторов. Стабилизация этих факторов позволяет получить воспроизводимые результаты и использовать это уравнение для количественного анализа:
 |
Im = a • n • F • ÖD • m (2/3) • t (1/6) • Со (8)
где а – числовой коэффициент; n- валентность; F- число Фарадея; D- коэффициент диффузии; m - масса капли или расход ртути; t- время жизни капли;
Задача.Кондуктометрический концентратомер
Двухэлектродная электролитическая ячейка была заполнена раствором KCl с удельной электропроводностью k0. Определите постоянную ячейки, если ее сопротивление оказалось равным Rя ( табл. 1):
Таблица 1.
Варианты исходных данных
| Вариант | Rя, Ом | Вариант | Rя, Ом |
| 10,8 | |||
| 20,3 | 14,5 | ||
| 21,8 | |||
| 13,7 | 12,8 |
Задание 2.
Дать описание оптико – акустического газоанализатора, его принципа действия, уравнения измерения, устройства, области применения.