 |
|
Методические указания
Измерение рН растворов и пульп производится потенциометрическим анализатором. Принцип действия основан на возникновении электродного потенциала на границе металл-раствор (равновесный потенциал), величина которого при прочих равных условиях зависит от концентрации ионов металла в растворе. При погружении металлического электрода в раствор, содержащий ионы этого металла, между поверхностью электрода и раствором установится равновесие по уравнению
Ме0 Û Меn+ + n e- (9)
Величина равновесного потенциала определится по уравнению Нернста; а именно:
Ex = E0 + (RT/nF) ln CMe+,
где Ex – потенциал металлического электрода при данной (искомой) концентрации ионов металла в растворе, В; E0 – потенциал этого же электрода в растворе с концентрацией ионов, равной единице (1N,1г-экв), называемый стандартным (нормальным)электродным потенциалом, В.
R=8,313 Дж – универсальная газовая постоянная;
F=96500 k – число Фарадея;
n – заряд ионов металла ( валентность);
T – температура раствора, К.
CMe+ -активная концентрация ( активность) ионов металла в растворе.
Величины некоторых нормальных электродных потенциалов приведены в приложении I.
Принимая коэффициент активности равным единице, температуру раствора равной t =+20 0С, перейдя к десятичным логарифмам и подставив значения физических постоянных (R,F) получают уравнение Нернста в следующем виде:
Ex = E0 + 0,058/n lg CMe
Прямым измерением определить величину потенциала Ex невозможно ( в любом случае возникает контактная пара). Для определения используют косвенное измерение, основанное на сравнении потенциала Exодного электрода, называемого измерительным (индикаторным), относительно потенциала другого электрода, называемого сравнительным (вспомогательным)электродом. Потенциал измерительного электрода изменяется в зависимости от концентрации ионов в растворе и его температуры по уравнению Нернста. Потенциал сравнительного электрода должен оставаться постоянным и не зависеть от концентрации ионов металла в растворе. Условно в качестве эталона выбран идеальный электрод сравнения, с потенциалом которого можно сравнивать потенциалы других электродов, называемый нормальным водородным электродом .
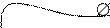
Нормальный водородный электрод выполнен в форме платиновой пластинки, покрытой платиновой чернью, насыщенной водородом при нормальном атмосферном давлении и имеющей площадь 1см2 (рис.5). Нормальный потенциал нормального водородного электрода условно принят равным нулю при всех значениях температуры раствора.
Рис. 5. Нормальный водородный электрод
 |


 Газообразный водород, растворенный Н2
Газообразный водород, растворенный Н2

 в металле, образует с ионами водорода
в металле, образует с ионами водорода

 окислительно-восстановительную
окислительно-восстановительную

 систему
систему



 Н2 2Н + 2е- (9)
Н2 2Н + 2е- (9)








Измерение рН. Показатель рН (р – potenzio, степень; Н – символ водорода ) введен датским ученым Лоренцом, чтобы упростить уравнение Нернста. Концентрация Н-ионов в растворе определяет кислотность растворов. По определению рН – это условный безразмерный показатель, численно равный отрицательному десятичному логарифму концентрации ионов водорода в растворе:
pН= - lg [ H+ ] (10)
С учётом данного выражения и того, что ионное произведение воды равно
10-14 ( уравнение 11)
Кн2о = = [H+][OH-] = 10 -14, (11)
легко получить значение рН нейтральной жидкости, например, дистиллированной воды: рН =7. Если рН <7, то среда кислая, если рН > 7 – среда щелочная.
Подставив соответствующие значения в уравнение Нернста, получим уравнение связи показателя рН и электродного потенциала измерительного электрода (для t =200C и Е0 = 0):
Ex = E0 + 0,058 lg[H +] = E0 - ( - 0,058 lg[H +] ) = - 0,058 pHx , B (12)
Из уравнения (12) следует:
функциональная зависимость между переменными линейная;
при изменении рН раствора на единицу потенциал электрода должен измениться на 58 мВ при данной температуре;
показания прибора будут зависеть от температуры раствора, т.е. может иметь место температурная погрешность. Потому в приборах предусмотрена схема автоматической компенсации температурной погрешности с помощью включения в измерительную схему термометра сопротивления, погруженного в раствор.
Устройство рН –метра.В состав рН – метра входят:
1) измерительная ячейка проточного или погружного типа, состоящая из измерительного и вспомогательного электродов;
2) электронный усилитель с высоким входным сопротивлением ( рис. 6).
По принципу действиявысокоомные усилители рН-метров делятся на три группы:
- приборы с непосредственным отсчетом;
- приборы с астатической компенсацией;
- приборы со статической компенсацией.
Наиболее распространены приборы последней группы благодаря более высокой стабильности и точности (рис.4).
По закону Кирхгофа измеряемая ЭДС равна Ех = Uвх + Uвых . В свою очередь Uвх = Uвых / К (К – коэффициент усиления усилителя).
Ех = Uвых/K + Uвых = Uвых ( 1/K + 1) (13)
При К=10 000 1/ K @ 0). Подставив это значение Uвх в уравнение, получим:
Ех = Uвых = Iвых R. (14)
Таким образом, сила выходного тока пропорциональна измеряемой ЭДС измерительной электродной ячейки рН - метра.
Измерительный стеклянный электрод( см. рис.7) представляет собой трубку1 из обычного (кремниевого ) стекла, имеющей на конце шарик из литиевого или натриевого стекла 3 диаметром 15-20 мм с толщиной стенок 0,006 – 0,1 мм. Трубка и шарик заполнены 0,1 N ( децинормальным) раствором 2 HCl , куда погружен контактный серебряный электрод 4. При погружении
такого электрода в раствор ионы лития или натрия замещаются ионами водорода из раствора за счет взаимной диффузии.





 Рис. 7. Измерительный стеклянный электрод:
Рис. 7. Измерительный стеклянный электрод:
 1
1


 4 2
4 2
 1 – трубка из силикатного стекла; 2 –раствор
1 – трубка из силикатного стекла; 2 –раствор

 электролита; 3 – шарик из литиевого стекла; 3
электролита; 3 – шарик из литиевого стекла; 3
 4 – контактный электрод
4 – контактный электрод
| |
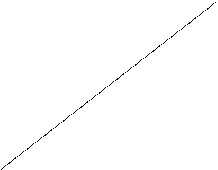
Потенциал стеклянного электрода меняется при изменении температуры контролируемого раствора вследствие изменения коэффициента RT/F в уравнении Нернста. Зависимость ЭДС электродной ячейки от рН и температуры представляет семейство прямых, пересекающихся в одной точке (И, см. рис.9). Эта точка называется изопотенциальной.Координаты изопотенциальной точки[рНи, Еи]являются важной характеристикой любой пары электродов и указываются в их паспорте. С учетом этихкоординатуравнение измерения для электродной системы примет окончательный вид:
Ex = Eи - ( S0 + at) ( pHи - pHx) , (15)
где Еи, рНи – координаты изопотенциальной точки;
S0 = D E / DpH = RT/F - крутизна водородной функции при 00 С;
а– температурный коэффициент; t – температура,0С.
Компенсация температурной погрешности рН – метра достигается путем включения в измерительную схему термометра сопротивления, погруженного в исследуемый раствор [1]. При технологических измерениях или поверке рН – метра предварительно выставляются координаты точки И, параметры крутизны S0.
| | |||
 |
|
 Ех,
Ех,
мВ
 |
 500
500
 |
 |

 300
300
|
 200
200



 Еи
Еи













 0
0
| |
 7 8 9 10 11
7 8 9 10 11
рНи водородный показатель, ед. рН
Рис. 9 . График зависимости Ех от рН и температуры раствора