 |
|
Фармакологическая терапия при тахиаритмиях
Прежде чем начинать фармакологическую антиаритмическую терапию, необходимо устранить факторы, способные провоцировать нарушения ритма сердца. К ним относятся транзиторные метаболические расстройства, застойная сердечная недостаточность, острая ишемия. В ряде случаев этого бывает достаточно для купирования аритмии. Кроме того, следует иметь в виду, что некоторые лекарственные препараты могут выступать в роли фактора, провоцирующего возникновение или усугубляющего уже имеющееся нарушение ритма сердца.
Антиаритмические препараты используют главным образом для купирования острой аритмии, предотвращения рецидива нарушения ритма сердца и профилактики ранее не возникавших нарушений ритма сердца, угрожающих жизни больного, риск развития которых довольно высок.
Индекс «токсическое действие/терапевтический эффект» большинства из имеющихся в настоящее время антиаритмический препаратов относительно низок. Тем не менее все они могут оказывать проаритмическое действие, т. е. усугублять уже имеющиеся нарушения сердечного ритма. В настоящее время можно определять сывороточные концентрации большинства доступных антиаритмических средств. Однако разработанные стандарты терапевтических и токсических уровней могут быть использованы лишь в качестве приблизительного руководства при выборе адекватной дозы препарата у конкретного больного. При анализе фармакологических параметров принято считать, что терапевтическим уровнем является такая концентрация препарата, при которой достигается ожидаемый антиаритмический эффект; а токсическим — концентрация, при которой возникают нежелательные побочные действия препаратов. Поскольку многие побочные реакции непосредственно зависят от концентрации препарата в крови, то для получения антиаритмического эффекта следует стремиться к созданию в сыворотке минимальных концентраций.
Для того чтобы определить терапевтический уровень препарата для каждого больного, следует руководствоваться стандартными подходами к оценке медикаментозной эффективности. У лиц с постоянными формами нарушений ритма сердца антиаритмические препараты можно вводить эмпирически до полного подавления аритмии. Если удается выявить фактор, провоцирующий нарушение ритма сердца, например физическую нагрузку, то можно предпринять попытку оценить антиаритмическую активность ряда препаратов, создавая определенные условия и индуцируя тем самым нарушения ритма. К сожалению, большинство нарушений ритма возникает спорадически и непредсказуемо, и идентифицировать подобные факторы не удается. В подобных случаях, если ожидать спонтанного появления аритмии на фоне приема каждого из известных антиаритмических средств, то для выявления эффективного препарата могут потребоваться месяцы. Такой путь подбора антиаритмической терапии допустим, если нарушения ритма сердца не представляют угрозы для жизни больного. Однако он неприемлем, если нарушения ритма приводят к нестабильности гемодинамики, обморокам или потенциально опасны для жизни пациента. В подобных случаях используют два подхода к оценке эффективности антиаритмических препаратов. Первый заключается в длительной регистрации ЭКГ до приема препарата и на фоне его приема. Он позволяет исследовать влияние препарата на спонтанную эктопическую активность предсердий или желудочков. В основе этого метода лежит предположение о том, что механизм, ответственный за возникновение стойкой аритмии и изолированных преждевременных сокращений, один и тот же. А следовательно, подавление изолированной эктопической активности означает исключение и стойкой аритмии. Эти положения не всегда бывают верными. Кроме того, данный метод имеет ряд недостатков. Во-первых, у пациентов нередко спонтанно возникает значительное уменьшение частоты эктопической активности, что может имитировать антиаритмический эффект используемого препарата. Во-вторых, у 25—30 % пациентов с таким стойкими желудочковыми нарушениями ритма, как фибрилляция желудочков или желудочковая тахикардия, спонтанная эктопическая активность возникает очень редко. Кроме того, у многих больных при спонтанной эктопической активности и стойких аритмиях эффект используемых антиаритмических препаратов различен.
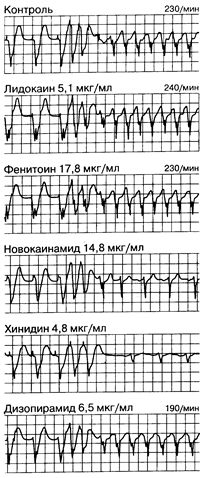
Рис.184-10. Выбор эффективного антриаритмического препарата при желудочковой тахикардии с помощью программной стимуляции. Сверху вниз: влияние программной стимуляции без лечения (контроль) и после введения ряда антиаритмических препаратов. В контрольном исследовании нанесение двух желудочковых экстрастимулов привело к развитию желудочковой тахикардии с ритмом 230 ударов в 1 мин. Лидокаин, фенитоин и дизопирамид при указанных концентрациях в плазме не смогли предотвратить развитие тахикардии. Новокаинамид и хинидин при указанных концентрациях в плазме препятствовали возникновению стойкой тахикардии. Постоянный пероральный прием хинидина оказался эффективным методом профилактики этого нарушения ритма. (Из: J. A. Kastor et al.)
Другим методом оценки эффективности антиаритмических средств является программная стимуляция миокарда. В целом ряде исследований было показано, что с помощью этого метода большинство суправентрикулярных и желудочковых тахиаритмий, возникающих в клинических условиях, можно воспроизводимо индуцировать и купировать, не вызывая осложнений. Первоначально исследования выполняют в исходном состоянии, без введения антиаритмических препаратов (рис. 184-10). Если у .больного удается повторно индуцировать возникавшую ранее аритмию, то затем исследуют способность каждого отдельного антиаритмического препарата предотвращать ее возникновение под влиянием электростимуляции. Для этого перед повторной стимуляцией препарат вводится либо внутривенно, либо перорально в течение нескольких дней до достижения постоянных его концентраций в сыворотке крови. Затем стимуляцию повторяют. Использование данного метода предполагает, что 1) индуцированная и спонтанная аритмия идентичны; 2) предотвращение возникновения аритмии на фоне введения препарата под влиянием электростимуляции означает способность выбранного режима антиаритмической терапии предотвращать спонтанное появление данной тахиаритмии. Этот метод был применен у больных с различными видами пароксизмальной суправентрикулярной тахикардии, в основе которых лежит феномен циркуляции возбуждения, а также у больных с желудочковой тахикардией и фибрилляцией желудочков. Метод зарекомендовал себя безопасным при условии правильного осуществления. Потенциальные осложнения связаны с катетеризацией сосудов. Правильность интерпретации результатов программной стимуляции во многом зависит от соответствия спонтанных и индуцированных нарушений ритма сердца с учетом их морфологии и частоты возникновения.
Было предложено несколько классификаций антиаритмических препаратов. Наиболее часто используют классификацию, предложенную Vaughn-Williams (см. табл. 184-1). В основе этой классификации лежит способность антиаритмических препаратов изменять 1) поляризующие ионные токи в клетках миокарда, прежде всего ионов натрия или кальция; 2) продолжительность потенциала действия и 3) автоматизм кардиомиоцитов (фаза 4 деполяризации). Считают, что подобные изменения, наблюдаемые в изолированных клетках миокарда под воздействием фармакологических препаратов, в некоторой степени отражают их антиаритмические эффекты в условиях in vivo. Таким образом, угнетение возбуждающих ионных токов под влиянием антиаритмических препаратов типов I и IV является результатом замедления проводимости. При введении этих препаратов нарушение ритма купируется в результате блокирования проведения импульсов в зонах с пограничной возбудимостью, где собственная проводимость тканей уже понижена. Антиаритмические препараты типа III оказывают свое действие, повышая рефрактерность за счет увеличения продолжительности потенциала действия. Недостатком данной классификации, однако является то, что она не учитывает возможного несоответствия электрофизиологических эффектов препаратов в условиях in vivo и при их влиянии на изолированную клетку. Показания к применению и свойства используемых в настоящее время антиаритмиков суммированы в табл. 184-2 и 184-3.184-3.
Таблица. Дозы, период полужизни после перорального введения и пути метаболизма препаратов, используемых для лечения больных с аритмиями
| Препарат | Путь введения | Период полужизни, ч | Путь метаболизма |
| Дигоксин | Внутривенно 0,75— 1,5 мг Перорально: нагрузочная доза 0,75— 1,5 мг в течение 12—24 ч; поддерживающая доза 0,25 — 0,50 мг/сут | Почки | |
| Анаприлин | Внутривенно 0,5—1,0 мг/мин до общей дозы 0,15—0,2 мг/кг Перорально 10—200 мг каждые 6 ч | 3—6 | Печень |
| Верапамил | Внутривенно 2,5—10 мг в течение 1 — 2 мин до общей дозы 0,15 мг/кг Перорально 80— 120 мг каждые 6—8 ч | 3—8 | » |
| Хинидин | Внутривенно 20 мг/мин до общей дозы 10 — 15 мг/кг Перорально 200 — 400 мг каждые 6 ч | 5—9 | » |
| Новокаинамид | Внутривенно 40—50 мг/мин до общей дозы 10—20 мг/кг Перорально 500—1000 мг каждые 4 ч | 3—5 | » Почки |
| Дизопирамид | Перорально 100—300 мг каждые 6—8 ч | 8—9 | » |
| Лидокаин | Внутривенно 20 — 50 мг/мин до общей нагрузочной дозы 5 мг/кг, затем 1 — 4 мг/мин | 1 —2 | Печень |
| Фенитоин | Внутривенно 20 мг/мин в общей дозе до 1000 мг Перорально нагрузочная доза 1000мг в течение 24 ч Поддерживающая доза 100— 400 мг/сут | 18—36 | |
| Токаинид | Перорально 400—600 мг каждые 8— 12 ч | 10— 17 | » Почки |
| Орнид | Внутривенно 1 — 2 мг/кг в 1 мин в общей дозе до 5— 10 мг/кг Поддерживающая доза 0,5 — 2 мг/мин | 8—14 | » |
| Амиодарон1 | Внутривенно 5 — 10 мг/кг Перорально нагрузочная доза 800 — 1400 мг/сут в течение 1 — 2 нед. Поддерживающая доза 100 — 600 мг/сут | Неизвестен | Печень |
| Мексилетин1 | Перорально 100—300 мг каждые 6—8 ч | 9—12 | » |
1Препараты находятся на стадии изучения.