 |
|
МЕТАЛЛЫ ГРУПП «В» (Побочных подгрупп)
1. Чем определяется принадлежность элементов к d- и f-электронным семействам? Сравните характер изменения атомных радиусов, энергий ионизации и электроотрицательности элементов в группах А и В.
а)Рассмотрите электронное строение атома марганца и определите его возможные степени окисления. Охарактеризуйте кислотные и окислительные свойства высшего оксида марганца. Составьте в молекулярной и ионно-молекулярной формах уравнения реакций взаимодействия перманганата калия с пероксидом водорода в кислой, нейтральной и сильнощелочной средах.
б) Напишите уравнения реакций, соответствующих превращениям:
FeСl3 → Fe(ОН)2 → Fe(OH)3 → NaFeO2 → Fe(NO3)3 → Fe3O4 .
2. Сравните электронное строение атомов хрома и серы и объясните причины различия свойств образуемых ими простых и сложных веществ. В какой степени окисления атомы этих элементов образуют схожие по свойствам однотипные соединения? Как это можно объяснить? Как влияет величина степени окисления атомов хрома на кислотно-основные и окислительно-восстановительные свойства его гидроксидов? Приведите уравнения соответствующих реакций.
а) Какие процессы происходят при пропускании избытка газообразного аммиака в водные растворы сульфатов меди(II), железа(III) и хрома(III)? Напишите уравнения соответствующих реакций и назовите вещества.
б) Напишите уравнения реакций, соответствующих превращениям:
CuS → Cu(OH)2 → (CuOH)2SO4 → CuS → CuCl2 → CuI .
3. Сравните электронное строение атомов хлора и марганца и объясните причины различия свойств образуемых ими простых и сложных веществ. В какой степени окисления атомы этих элементов образуют схожие по свойствам однотипные соединения? Как это можно объяснить? Приведите примеры такого сходства.
а) В виде каких частиц Cr(III) содержится в сильнокислых и в сильнощелочных водных растворах? Какие процессы происходят при постепенном добавлении раствора NaOH к подкисленному раствору хлорида хрома(III)? Составьте уравнения соответствующих реакций в молекулярной и ионно-молекулярной формах и назовите вещества.
б) Напишите уравнения реакций, соответствующих превращениям:
MnSO4 → HMnO4 → MnO2 → K2MnO4 → KMnO4 → Mn(OH)2 .
4. Рассмотрите электронное строение атома железа и определите его возможные степени окисления. В какой из них железо образует наиболее устойчивые соединения? Какими химическими свойствами обладает железо? Как изменяются кислотно-основные и окислительно-восстановительные свойства гидроксидов железа с повышением степени его окисления? Ответ подтвердите уравнениями соответствующих реакций.
а) Напишите уравнения реакций взаимодействия дихромата калия с сульфидом калия в нейтральном растворе при нагревании; дихромата натрия с сульфитом натрия в растворе, содержащем серную кислоту; термического разложения дихромата аммония.
б) Напишите уравнения реакций, соответствующих превращениям:
Cr2O3 → K2Cr2O7 → Cr(OH)3 → NaCrO2 → Na2CrO4 → CrO3 .
5. Рассмотрите электронное строение атома меди и определите его возможные степени окисления. В какой из них медь образует наиболее устойчивые соединения? Охарактеризуйте химические свойства меди. Сравните устойчивость и кислотно-основные свойства ее оксидов и гидроксидов, напишите уравнения соответствующих реакций. Где используются медь и ее соединения? Перечислите важнейшие из них.
а) Какие из ионов –  или
или 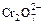 более устойчивы в кислой среде; в щелочной среде? Напишите уравнения реакций взаимодействия в водных растворах хромата калия с серной кислотой; дихромата натрия с гидроксидом натрия; дихромата натрия с хлоридом бария.
более устойчивы в кислой среде; в щелочной среде? Напишите уравнения реакций взаимодействия в водных растворах хромата калия с серной кислотой; дихромата натрия с гидроксидом натрия; дихромата натрия с хлоридом бария.
б) Напишите уравнения реакций, соответствующих превращениям:
Zn → Na2[Zn(OH)4] → Zn(OH)2 → ZnS → Na2ZnO2 → ZnO .
6. Рассмотрите электронное строение атома хрома и определите его возможные степени окисления. В какой из них хром образует наиболее устойчивые соединения? Охарактеризуйте термическую устойчивость, кислотные и окислительные свойства оксида хрома(VI). Какие кислоты ему соответствуют? Как соли этих кислот превращаются друг в друга?
а) Как в промышленности получают перманганат калия?
Какое влияние оказывает величина рН растворов на окислительные свойства перманганата калия? В какой среде они выражены наиболее сильно? Напишите уравнения реакций взаимодействия перманганата калия с сульфитом натрия в присутствии гидроксида натрия; в присутствии серной кислоты; в нейтральном водном растворе. Какие вещества образуются при термическом разложении перманганата калия; оксида марганца(IV)?
б) Напишите уравнения реакций, соответствующих превращениям:
Сu(NO3)2 → CuCl2 → Cu2S → CuSO4 → CuS → Cu(OH)2 .
7. Рассмотрите электронное строение атома цинка. Какую единственную степень окисления проявляет цинк в своих соединениях? Почему? Охарактеризуйте химические свойства цинка, его оксида и гидроксида. Какова роль цинка в процессах жизнедеятельности человека, животных и растений?
Каков характер воздействия кадмия, ртути и их растворимых соединений на живые организмы? Как можно обезвредить пролитую ртуть?
а) Охарактеризуйте взаимодействие железа, кобальта и никеля с азотной, серной соляной и фосфорной кислотами. В контакте с какими из перечисленных кислот железо пассивируется? В каких условиях указанные металлы реагируют с водой? Напишите уравнения соответствующих реакций.
б) Напишите уравнения реакций, соответствующих превращениям:
Cr2O3 → CrSO4 → K3[Cr(OH)6] → K2CrO4 → CrO3 → (NH4)2Cr2O7 .
8. Как изменяются кислотно-основные и окислительно-восстановительные свойства оксидов и гидроксидов хрома с повышением степени его окисления? Какие продукты образуются при термическом разложении оксида хрома(VI); дихромата аммония; нитрата хрома(III)? Напишите уравнения соответствующих реакций.
а) Сравните устойчивость перманганата и манганата калия в водных растворах. Напишите уравнение реакции взаимодействия манганата калия с водой. Почему разложение соли усиливается при пропускании в ее раствор оксида углерода(IV) или при добавлении растворов кислот? Как можно замедлить разложение манганатов в растворах? Ответ подтвердите уравнениями соответствующих реакций.
б) Напишите уравнения реакций, соответствующих превращениям:
FeS2 → Fe2(SO4)3 → Fe2О3 → NaFeO2 → Fe(OН)3 → Na2FeO4 .
9. Как и почему в группах по мере увеличения атомных номеров изменяются устойчивость, кислотные и окислительные свойства высших оксидов и гидроксидов d-элементов? Сравните эту закономерность с аналогичной для p-элементов. Какой из оксидов – CrO3, MoO3 или WO3 – является наиболее сильным окислителем? У какого из оксидов – Mn2O7, Re2O7 или Tc2O7 – наиболее слабо выражены кислотные свойства?
а) Какое равновесие устанавливается в водных растворах дихроматов? Почему при взаимодействии в растворах солей бария с хроматами и дихроматами образуются осадки одинакового состава? Напишите уравнения соответствующих реакций в молекулярной и ионно-молекулярных формах.
б)Напишите уравнения реакций, соответствующих превращениям:
Zn → Na2[Zn(OH)4] → Zn(OH)2 → ZnS → Na2ZnO2 → Zn(NO3)2 .
0. Каковы особенности строения атомов d-элементов, отличающие их от s- и p-элементов? Какие электроны являются валентными в атомах d-элементов? Всегда ли высшие степени окисления d-элементов численно равны номерам соответствующих групп? Приведите примеры. Почему катионы и атомы d-элементов являются типичными комплексообразователями, образующими наиболее прочные комплексные частицы?
а) Перечислите важнейшие природные соединения железа. Какие химические реакции используются для его промышленного получения? Как получают особо чистое «карбонильное» железо? Чем по составу и механическим свойствам чугун отличается от стали? Какие компоненты входят в состав нержавеющих сталей?
б)Напишите уравнения реакций, соответствующих превращениям:
MnO2 → Mn(OH)2 → HMnO4 → MnCl2 → MnO2 → KMnO4 .
Т е м а ХVII