 |
|
А) Комплексообразователь, лиганды, внутреннюю и внешнюю сферы
Б) Определить: степень окисления комплексообразователя и координационное число
г)Написать уравнение диссоциации комплекса, привести выражение константы нестойкости (Кнест)
Д) Назвать это соединение
Пример. В комплексном соединении K3[Fe(CN)6] отметьте: комплексообразователь, лиганды, внутреннюю и внешнюю сферы. Определите: степень окисления комплексообразователя и координационное число. Напишите уравнение диссоциации комплекса, приведите выражение константы нестойкости (Кнест). Назовите соединение.
Р е ш е н и е
В данном соединении комплексообразователь Fe3+. Степень окисления иона железа определяется исходя из нейтральности соединения в целом и зарядов входящих в него других частиц: К+ и CN- ; лиганды - ионы CN-; координационное число - 6; внутренняя сфера [Fe(CN)6]3-; внешняя сфера К+.
Комплекс диссоциирует в растворе по уравнению:
[Fe(CN)6]3- 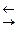 Fe3+ + 6CN-,
Fe3+ + 6CN-,
Кнест =  .
.
В соответствии с правилами ИЮПАК это соединение называется: гексацианоферрат(III) калия.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Для данного химического уравнения:
А) 1. Вычислить, сколько тепла выделится при сгорании 100 л углеводорода
2. Определить энтальпию образования оксида элемента
б) Рассчитать термодинамические характеристики – ∆H0298, S0298, ∆G0298, определить, будет ли реакция протекать самопроизвольно. Вычислить температуру начала реакции и константу равновесия при определенной температуре.
Пример. Реакция горения протекает по уравнению
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О + 890,31 кДж
Вычислите сколько тепла выделится при сгорании 100 л (н.у.) углеводорода?
Р е ш е н и е
В данном термодинамическом уравнении дано значение стандартной энтальпии сгорания 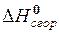 , то есть тепловой эффект реакции окисления 1 моля (22,4 л) газообразного метана (СН4). 100 л газа в нормальных условиях (н.у.) соответствуют
, то есть тепловой эффект реакции окисления 1 моля (22,4 л) газообразного метана (СН4). 100 л газа в нормальных условиях (н.у.) соответствуют  молям газа, следовательно при сгорании 100 л газа выделится
молям газа, следовательно при сгорании 100 л газа выделится 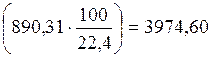 кДж тепла (зависимостью ΔН от температуры пренебречь).
кДж тепла (зависимостью ΔН от температуры пренебречь).
Пример.При соединении 27 г алюминия с кислородом выделилось 836,8 кДж тепла. Определите энтальпию образования оксида алюминия (Al2O3).
Р е ш е н и е
Энтальпией образования сложного соединения называется тепловой эффект образования 1 моля этого соединения из простых веществ, взятых в устойчивом
состоянии при заданных условиях. То есть для получения 1 моля Al2O3 необходимо 2 моля атомов Al, что составляет 54 г.
По условию задачи:
при соединении 27 г алюминия выделится 836,8 кДж
при соединении 54 г алюминия выделится Q кДж
 кДж/моль
кДж/моль
 кДж/моль.
кДж/моль.
Пример . Вычислите  (кДж),
(кДж),  (Дж/К),
(Дж/К),  (кДж) для следующей реакции: 2СО (г) + 2Н2 (г) = СН4 (г) + СО2 (г).
(кДж) для следующей реакции: 2СО (г) + 2Н2 (г) = СН4 (г) + СО2 (г).
Возможна ли реакция при Р = 1 атм и Т = 298 К? Вычислите температуру начала реакции и константу равновесия при 1000 К. О чем свидетельствуют значения температуры начала реакции и 
Р е ш е н и е
По закону Гесса определяем  и
и  (термодинамические параметры из Приложения 2, таблица 1).
(термодинамические параметры из Приложения 2, таблица 1).
 =
=  = -247,35 кДж.
= -247,35 кДж.
 = -256,21 Дж/К.
= -256,21 Дж/К.
 определяем по второму закону термодинамики:
определяем по второму закону термодинамики:
 =
=  - 298·
- 298·  = -247,35 - 298·(-256,21) ·10-3 = -170,99 кДж, то есть реакция при 298К термодинамически вероятна.
= -247,35 - 298·(-256,21) ·10-3 = -170,99 кДж, то есть реакция при 298К термодинамически вероятна.
Температура начала реакции – это Травн, когда  = 0.
= 0.
 выше 965К реакция термодинамически невероятна.
выше 965К реакция термодинамически невероятна.
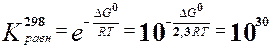 . Большое значение
. Большое значение 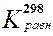 свидетельствует о том, что в стандартных условиях идет практически только прямая реакция.
свидетельствует о том, что в стандартных условиях идет практически только прямая реакция.
Кравн при 1000К определяем по формуле
 .
.
Следовательно, при Т = 1000К реакция идет с большей скоростью в обратном направлении.
Ответ:  = -247,35 кДж;
= -247,35 кДж;  = -256 Дж/К;
= -256 Дж/К;  = -170,99 кДж;
= -170,99 кДж;
Травн = 965К; 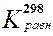 = 1030;
= 1030;  = 0,34.
= 0,34.