 |
|
Исследование органов брюшной полости
Гепатомегалиявыявляется практически у всех больных декомпенсированным ЛС. Печень увеличена в размерах, при пальпации уплотнена, болезненна, край печени закруглен. Тем не менее, проводя исследование больных с хроническим ЛС, следует помнить, что нижние границы печени у этих больных могут быть опущены за счет выраженной эмфиземы легких. Поэтому при исследовании таких больных не следует ограничиваться перкуссией и пальпацией нижнего края печени: необходимо определять размеры этого органа по Курлову или Образцову.
Выраженная правожелудочковая недостаточность сопровождается появлением свободной жидкости в брюшной полости — асцитом.
Осмотр, пальпация и перкуссия сердца
Осмотр и пальпация сердца позволяют выявить гипертрофию и дилатацию ПЖ еще на стадии компенсированного легочного сердца, т.е. до появления первых клинических признаков правожелудочковой недостаточности. Наиболее характерно появление сердечного толчка — выраженной разлитой пульсации слева от грудины, в зоне абсолютной тупости сердца, а также в эпигастральной области, обусловленной гипертрофированным и дилатированным ПЖ (рис. 13.6). Этот важнейший клинический признак долгое время остается единственным указанием на наличие у больного с хроническими заболеваниями легких морфологических изменений в ПЖ, вызванных легочной АГ.
Смещение вправо правой границы относительной тупости сердца, а также расширение абсолютной тупости сердца (рис. 13.7) указывают на наличие выраженной дилатации ПЖ.
| Рис. 13.6. Сердечный толчок и эпигастральная пульсация у больного с хроническим легочным сердцем | 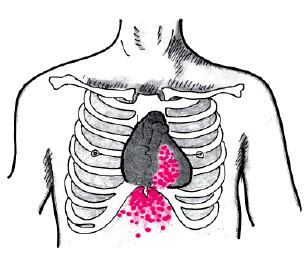
|
| Рис. 13.7. Изменение границ относительной и абсолютной тупости сердца при хроническом легочном сердце | 
|
Аускультация сердца
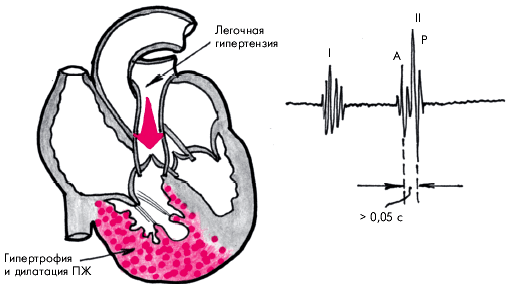
Наиболее характерным аускультативным признаком легочной АГ является акцент II тона на легочной артерии. Расщепление II тона во II межреберье слева от грудины, также нередко выявляемое у больных с легочной АГ, обычно указывает на замедление изгнания крови из гипертрофированного ПЖ, более позднее закрытие створок клапана легочной артерии и, соответственно, более позднее формирование пульмонального компонента II тона (рис. 13.8).
|
| Рис. 13.8. Механизм формирования акцента и расщепления II тона при хроническом легочном сердце |
I тон сердца может быть несколько ослаблен за счет более медленного сокращения гипертрофированного и дилатированного ПЖ. В то же время у половины больных компенсированным и субкомпенсированным ЛС I тон сохранен или даже несколько усилен, что связывают с поворотом сердца вокруг продольной оси и приближением гипертрофированного и дилатированного ПЖ к поверхности грудной клетки.
Правожелудочковый IV тон сердцаиногда выявляется при выраженной гипертрофии ПЖ. Его появление у больных с ЛС косвенно может указывать на наличие выраженной диастолической дисфункции ПЖ и увеличение вклада ПП в его диастолическое наполнение. При возникновении систолической дисфункции ПЖ и выраженной его объемной перегрузки иногда выявляется правожелудочковый патологический III тон сердца.
Следует подчеркнуть, что в далеко зашедших случаях ЛС при выраженной дилатации ПЖ может развиться относительная недостаточность трехстворчатого клапана, аускультативным проявлением которой является систолический шум в трикуспидальной зоне, усиливающийся при глубоком вдохе (симптом Риверо–Корвалло).
Наконец, в редких случаях в месте аускультации легочной артерии (II межреберье слева от грудины) и вдоль левого края грудины выслушивается мягкий, дующий диастолический шум, начинающийся сразу после II тона. Шум обусловлен относительной недостаточностью клапана легочной артерии вследствие ее расширения, связанного с длительным существованием легочной АГ (см. главу 8).
Артериальный пульс и АД
При выраженной легочной АГ и снижении систолической функции ПЖ нередко наблюдается уменьшение притока крови к левым отделам сердца, что сопровождается отчетливой тенденцией к снижению системного АД. В тяжелых случаях заболевания уменьшается наполнение, напряжение и величина артериального пульса. Иногда можно выявить парадоксальный пульс в виде снижения систолического АД во время вдоха больше чем на 10 мм рт. ст. (см. главу 12). Как правило, выявляется тахикардия, а также разнообразные нарушения ритма сердца.
 Запомните
Наиболее диагностически значимыми объективными признаками хронического ЛС и легочной АГ являются: 1. Наличие выраженного разлитого сердечного толчка и эпигастральной пульсации (гипертрофия и дилатация ПЖ). 2. Акцент и расщепление II тона на легочной артерии (высокое давление в легочной артерии и замедление изгнания крови из ПЖ). 3. Смещение вправо правой границы сердца и расширение абсолютной тупости сердца (дилатация ПЖ). 4. Появление клинических признаков правожелудочковой недостаточности (смешанный цианоз, отеки, набухание шейных вен, гепатомегалия, гидроторакс, асцит). 5. Сочетание каждого из указанных признаков с наличием у больного хронических заболеваний бронхолегочного аппарата, поражения легочных сосудов или торако-диафрагмальными поражениями. Запомните
Наиболее диагностически значимыми объективными признаками хронического ЛС и легочной АГ являются: 1. Наличие выраженного разлитого сердечного толчка и эпигастральной пульсации (гипертрофия и дилатация ПЖ). 2. Акцент и расщепление II тона на легочной артерии (высокое давление в легочной артерии и замедление изгнания крови из ПЖ). 3. Смещение вправо правой границы сердца и расширение абсолютной тупости сердца (дилатация ПЖ). 4. Появление клинических признаков правожелудочковой недостаточности (смешанный цианоз, отеки, набухание шейных вен, гепатомегалия, гидроторакс, асцит). 5. Сочетание каждого из указанных признаков с наличием у больного хронических заболеваний бронхолегочного аппарата, поражения легочных сосудов или торако-диафрагмальными поражениями.
| ||
| 13.4. Лабораторная и инструментальная диагностика | ||

| ||
Анализ крови
В клиническом анализе крови у больных хроническим ЛС в большинстве случаев выявляется эритроцитоз, увеличение гематокрита и содержания гемоглобина, что является весьма характерным для хронической артериальной гипоксемии. В тяжелых случаях развивается полицитемия с увеличением содержания эритроцитов, тромбоцитов и лейкоцитов. Уменьшение СОЭ часто ассоциируется с повышением вязкости крови, что также закономерно наблюдается у многих больных, страдающих дыхательной недостаточностью.
Описанные изменения в анализах крови, естественно, не являются прямым доказательством наличия ЛС, но они, как правило, указывают на выраженность легочной артериальной гипоксемии — основного звена патогенеза хронического ЛС.
Электрокардиография
При электрокардиографическом исследовании у больных хроническим ЛС выявляются признаки гипертрофии ПЖ и ПП. Наиболее ранние изменения ЭКГ — это появление в отведениях II, III, aVF (иногда в V1) высокоамплитудных, с заостренной вершиной, зубцов Р (P-pulmonale), причем их длительность не превышает 0,10 с.
Несколько позже начинают выявляться ЭКГ-признаки гипертрофии ПЖ.В зависимости от уровня давления в легочной артерии, величины мышечной массы ПЖ и выраженности сопутствующей эмфиземы легких у больных ЛС можно выявить три типа ЭКГ-изменений, два из которых описаны в главе 8. Напомним, что rSR'-типнаблюдается при умеренной гипертрофии ПЖ, когда его масса приближается к массе миокарда ЛЖ или несколько меньше ее (рис. 13.9):
- появление в отведении V1 комплекса QRS типа rSR';
- увеличение амплитуды зубцов R'V1 и SV5, 6 ; при этом амплитуда R'V1 > 7 мм или R'V1 + SV5, 6 > 10,5 мм;
- признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
- увеличение длительности интервала внутреннего отклонения в правом грудном отведении (V1) больше 0,03 с;
- смещение сегмента RS–T вниз и появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
- смещение электрической оси сердца вправо (угол a > +100°) (непостоянный признак).
| Рис. 13.9. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и rSr'-тип гипертрофии ПЖ) | 
|
qR-тип выявляетсяпри выраженной гипертрофии ПЖ, когда его масса несколько больше массы миокарда ЛЖ. Для этого типа ЭКГ-изменений характерно (рис. 13.10):
- появление в отведении V1 комплекса QRS типа QR или qR;
- увеличение амплитуды зубцов RV1 и SV5, 6. При этом амплитуда RV1 > 7 мм или RV1 + SV5, 6 > 10,5 мм;
- признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
- увеличение длительности интервала внутреннего отклонения в правом грудном отведении (V1) более 0,03 с;
- смещение сегмента RS–T вниз и появление отрицательных зубцов Т в отведениях III, aVF, V1 и V2;
- смещение электрической оси сердца вправо (угол a > +100°) (непостоянный признак).
Таким образом, основные отличия этих двух типов ЭКГ-изменений при гипертрофии ПЖ заключаются в форме комплекса QRS в отведении V1.
| Рис. 13.10. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и qR-тип гипертрофии ПЖ) | 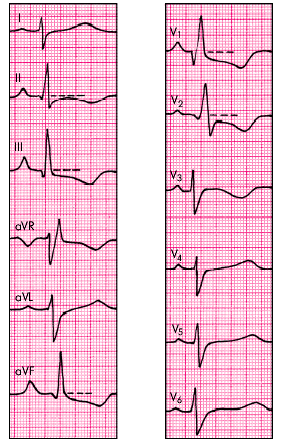
|
S-тип ЭКГ-изменений часто наблюдается у больных с выраженной эмфиземой легких и хроническим ЛС, когда гипертрофированное сердце резко смещается кзади, преимущественно за счет эмфиземы. При этом вектор деполяризации желудочков проецируется на отрицательные части осей грудных отведений и отведений от конечностей (признаки поворота сердца вокруг поперечной оси верхушкой кзади). Это объясняет существенные особенности изменений комплекса QRS у этих больных (рис. 13.11):
- во всех грудных отведениях от V1 до V6 комплекс QRS имеет вид rS или RS c выраженным зубцом S;
- в отведениях от конечностей часто регистрируется синдром SISIISIII (признак поворота сердца вокруг поперечной оси верхушкой кзади);
- на ЭКГ выявляются признаки поворота сердца вокруг продольной оси по часовой стрелке (смещение переходной зоны влево, к отведениям V5, V6, и появление в отведениях V5, V6 комплекса QRS типа RS);
- определяется вертикальная позиция электрической оси сердца.

|
| Рис. 13.11. Электрокардиограмма больного с хроническим легочным сердцем (Р-pulmonale и S-тип гипертрофии ПЖ) |
Следует отметить, что при всех трех типах ЭКГ-изменений диагноз гипертрофии ПЖ косвенно подтверждается наличием признаков гипертрофии ПП (P-pulmonale), выявляемых в отведениях II, III и aVF.
Рентгенологическое исследование
Рентгенологическое исследование позволяет уточнить характер поражения легких, а также выявить несколько важных рентгенологических признаков, указывающих на увеличение размеров ПЖ и наличие легочной АГ (рис. 13.12 и 13.13):
1. Выбухание ствола легочной артерии в правой передней косой проекции и реже в прямой проекции (расширение II дуги левого контура сердца).
2. Расширение корней легких.
3. Увеличение размеров ПЖ в правой и левой передней, а также в левой боковой проекциях и уменьшение ретростернального пространства (рис. 13.13).
4. Значительное выбухание заднего контура тени сердца вплоть до сужения ретрокардиального пространства, что наблюдается при выраженной гипертрофии и дилатации ПЖ, который смещает ЛЖ кзади (см. рис. 13.13, б).
5. Расширение ствола и центральных ветвей легочной артерии, которое сочетается с обеднением сосудистого рисунка на периферии легочных полей за счет сужения мелких легочных артерий.
| Рис. 13.12. Рентгенограмма сердца в прямой проекции больного с хроническим легочным сердцем | 
|
| Рис. 13.13. Смещение контуров тени сердца в правой передней (а) и левой передней (б) проекциях при значительной дилатации и гипертрофии правого желудочка (схема). Заметно значительное сужение ретростернального пространства и выбухание ствола легочной артерии. Ретрокардиальное пространство также сужено (б) за счет оттеснения левого желудочка кзади увеличенным правым желудочком | 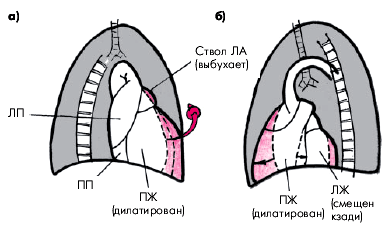
|
Эхокардиография
Эхокардиографическое исследование у больных хроническим ЛС проводится с целью:
- объективного подтверждения наличия гипертрофии ПЖ и ПП;
- оценки систолической функции ПЖ;
- косвенного определения давления в легочной артерии.
1. Выявление гипертрофии миокарда правого желудочка.Эхокардиографическая диагностика гипертрофии ПЖ представляет достаточно сложную проблему. Это связано, прежде всего, с трудностями, возникающими при ручном контурировании эндокарда желудочка, отличающегося выраженной трабекулярностью, а также с недостаточной визуализацией этого отдела сердца, бульшая часть которого в норме расположена за грудиной.
Гипертрофия миокарда ПЖ может быть диагностирована при М-модальном (одномерном) исследовании с достаточно высокой степенью вероятности при толщине передней стенки ПЖ, превышающей 5 мм (рис. 13.14). Правда, это справедливо только в тех случаях, когда при ультразвуковом исследовании достигнута хорошая визуализация эндокарда передней стенки ПЖ.
Предварительное двухмерное исследование из парастернального доступа по короткой оси сердца или из апикальной четырехкамерной позиции нередко позволяет добиться лучшей визуализации ПЖ и выбрать оптимальное направление ультразвукового луча, пересекающего стенку ПЖ при М-модальном исследовании.
Несомненно, что более тщательный поиск признаков гипертрофии миокарда ПЖ показан в тех случаях, когда при двухмерном исследовании определяется дилатация этого отдела сердца, в большинстве случаев указывающая на наличие объемной или систолической перегрузки ПЖ.
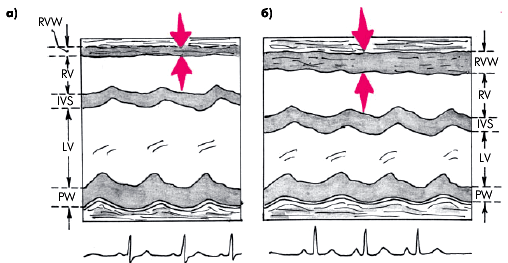
|
| Рис. 13.14. Определение толщины передней стенки правого желудочка (RVW) по одномерным эхокардиограммам, зарегистрированным из парастернального доступа у здорового человека (а) и больного хроническим легочным сердцем с гипертрофией правого желудочка (б) |

|
| Рис. 13.15. Двухмерные эхокардиограммы, зарегистрированные в апикальной четырехкамерной позиции в норме (а) и у больного хроническим легочным сердцем с выраженной дилатацией правого желудочка (б). В последнем случае верхушка сердца образована ПЖ, объем которого существенно превышает объем ЛЖ, отмечается парадоксальное движение МЖП в сторону левого желудочка (отмечено стрелкой) |
2. Оценка систолической функции правого желудочка подробно описана в главе 2. Напомним, что эта оценка основана, прежде всего, на выявлении признаков дилатации ПЖ, например, при регистрации М-модальной ЭхоКГ из парастернального доступа по короткой оси сердца (см. рис. 2.32). В норме КДРПЖ составляет около 15–20 мм, а при дилатации ПЖ обычно превышает 26 мм.
Дилатация ПЖ сравнительно хорошо выявляется при двухмерном исследовании в парастернальной позиции по короткой оси (см. рис. 2.33), а также в апикальной четырехкамерной позиции, в которой дилатированный ПЖ как бы оттесняет ЛЖ в сторону, занимая, хотя бы частично, верхушку сердца (рис. 13.15, б), в норме образованную только ЛЖ (рис. 13.15, а).
Сократимость ПЖчаще всего оценивается визуально, качественно — по характеру и амплитуде движения передней стенки ПЖ и МЖП. Например, объемная перегрузка ПЖ у больных с декомпенсированным ЛС характеризуется не только расширением его полости, но также усиленной пульсацией его стенок и парадоксальными движениями МЖП: во время систолы МЖП прогибается в полость ПЖ, а во время диастолы — в сторону ЛЖ.
Наконец, косвенно о нарушении функции ПЖ можно судить также по размерам ПП, которое обычно хорошо визуализируется из парастернального доступа по короткой оси на уровне основания сердца; из апикальной четырехкамерной позиции и из субкостального доступа по длинной и короткой осям. В норме ПП и ЛП в этих позициях имеют примерно одинаковые размеры. Дилатация ПП приводит к доминированию его изображения.
Следует добавить, что систолическая дисфункция ПЖ может быть оценена по степени коллабирования нижней полой вены во время вдоха. В норме на высоте глубокого вдоха коллабирование нижней полой вены составляет примерно 50%. Недостаточное ее спадение на вдохе указывает на повышение давления в ПП и в венозном русле большого круга кровообращения.
3. Диагностика легочной артериальной гипертензии необходима для оценки тяжести течения и прогноза хронического ЛС. С этой целью используется допплеровское исследование формы потока крови в выносящем тракте ПЖ и в устье клапана легочной артерии. При нормальном давлении в легочной артерии форма потока крови приближается к куполообразной и симметричной, а при легочной гипертензии становится треугольной или двухпиковой (см. рис. 2.35).
Количественное определение систолического давления в легочной артерии (СДЛА) возможно при использовании постоянно-волнового допплеровского исследования трикуспидальной регургитации, а диастолического давления — при оценке максимальной скорости диастолической регургитации крови из легочной артерии в ПЖ. Методика эхокардиографического определения систолического, диастолического и среднего давления в легочной артерии изложена в главе 2.
Катетеризация правых отделов сердца и легочной артерии
Катетеризация правых отделов сердца является основным методом прямого измерения давления в легочной артерии. Исследование проводят в специализированных клиниках по стандартной методике (см. главу 6), используя “плавающий” катетер Свана–Ганца. Катетер вводится через внутреннюю яремную, наружную яремную, подключичную или бедренную вену в правое предсердие, затем в правый желудочек и легочную артерию, измеряя давление в этих камерах сердца. Когда катетер находится в одной из ветвей легочной артерии, баллончик, расположенный на конце катетера, раздувают. Кратковременная окклюзия сосуда позволяет измерять давление окклюзии легочной артерии (давление заклинивания — ДЗЛА), которое примерно соответствует давлению в легочных венах, ЛП и конечно-диастолическому давлению в ЛЖ.
При катетеризации полостей сердца и легочной артерии у больных хроническим ЛС выявляют достоверные признаки легочной гипертензии — значения давления в легочной артерии больше 25 мм рт. ст. в покое или больше 35 мм рт. ст. при нагрузке. При этом остается нормальным или даже пониженным давление заклинивания легочной артерии (ДЗЛА) — не больше 10–12 мм рт. ст. Напомним, что для больных с левожелудочковой недостаточностью или пороками сердца, сопровождающимися венозным застоем крови в легких, повышенное давление в легочной артерии сочетается с повышением ДЗЛА до 15–18 мм рт. ст. и выше.
Исследование функции внешнего дыхания
Как было показано выше, в основе возникновения легочной АГ и формирования хронического ЛС в большинстве случаев лежат нарушения функции внешнего дыхания, ведущие к развитию альвеолярной гипоксии и легочной артериальной гипоксемии. Поэтому тяжесть течения, прогноз и исходы хронического ЛС, а также выбор наиболее эффективных способов лечения этого заболевания во многом определяются характером и выраженностью нарушений функции легких. В связи с этим основными задачами исследования функции внешнего дыхания (ФВД) у больных ЛС являются:
- диагностика нарушений функции внешнего дыхания и объективная оценка тяжести дыхательной недостаточности;
- дифференциальная диагностика обструктивных и рестриктивных расстройств легочной вентиляции;
- обоснование патогенетической терапии дыхательной недостаточности;
- оценка эффективности проводимого лечения.
Эти задачи решаются с помощью ряда инструментальных и лабораторных методов исследования: спирометрии, спирографии, пневмотахографии, тестов на диффузионную способность легких и др.
Наиболее информативными показателями ФВД, которые используются для оценки функционального состояния легких у больных хроническим ЛС, являются следующие:
1. Общая емкость легких (ОЕЛ).
2. Жизненная емкость легких (ЖЕЛ).
3. Остаточный объем легких (ООЛ).
4. Функциональная остаточная емкость (ФОЕ).
5. Объем форсированного выдоха за первую секунду (ОФВ1).
6. Индекс Тиффно (ОФВ1/ФЖЕЛ, %) — отношение объема форсированного выдоха за первую секунду (ОФВ1, или FEV1) к форсированной жизненной емкости легких (ФЖЕЛ, или FVC).
7. Максимальная объемная скорость выдоха на уровне 25%, 50% и 75% форсированной жизненной емкости легких (МОС25%, МОС50%, МОС75%).
8. Средняя объемная скорость выдоха на уровне 25–75% от ФЖЕЛ (СОС25–75%).
9. Пиковая объемная скорость выдоха (ПОСвыд).
Способы определения этих и некоторых других показателей ФВД, а также интерпретация выявляемых изменений, подробно обсуждаются в последующих главах руководства.
| 13.5. Лечение |

|
В основе лечения больных с хроническим ЛС лежат мероприятия, направленные, прежде всего, на предотвращение легочной АГ и правожелудочковой недостаточности. Это возможно только при активном воздействии на основной патологический процесс в легких, приведший к возникновению ЛС. Успех лечения зависит в первую очередь от улучшения альвеолярной вентиляции, коррекции артериальной гипоксемии, гиперкапнии и ацидоза. Воздействие на эти, главные, звенья патогенеза ЛС в большинстве случаев уменьшает напряженность гипоксической легочной вазоконстрикции и способствует снижению давления в легочной артерии даже на стадии декомпенсированного ЛС.
Коррекция легочной артериальной гипоксемии
Наиболее эффективными методами коррекции альвеолярной вентиляции и газового состава крови у большинства больных ЛС являются:
· ингаляция кислорода;
· применение бронхолитиков;
· применение антибиотиков.
1. Ингаляция кислорода является одним из наиболее эффективных методов коррекции артериальной гипоксемии и гиперкапнии. Она позволяет восстанавливать поврежденные при дыхательной недостаточности функции ЦНС, печени, почек; устраняет метаболический ацидоз, уменьшает катехоламинемию, улучшает механические свойства самих легких и т.п.
Показаниями для назначения кислородотерапии являются следующие клинические симптомы, возникающие у больного с дыхательной недостаточностью (А.П. Зильбер):
· выраженный цианоз;
· тахипноэ;
· тахикардия или брадикардия;
· системная артериальная гипотензия или гипертензия;
· признаки метаболического ацидоза;
· признаки артериальной гипоксемии (парциальное давление кислорода в артериальной крови — РаО2 — ниже 65 мм рт. ст.).
В стационарах для ингаляции кислорода обычно используют носовой катетер, что создает меньше дискомфорта для пациента, позволяя ему говорить, принимать пищу, кашлять и т.д. При этом во вдыхаемой смеси создается достаточно безопасная концентрация кислорода, не превышающая 40%. Это позволяет длительно, на протяжении нескольких дней или даже недель, осуществлять оксигенотерапию, не опасаясь развития ее осложнений. В некоторых случаях оксигенотерапию проводят с помощью лицевой маски, которая обеспечивает более высокую концентрацию кислорода. Нельзя использовать для оксигенотерапии вдыхание 100% кислорода, так как это способствует угнетению дыхательного центра и развитию гиперкапнической комы. Следует также помнить, что при ингаляции кислорода требуется обязательное увлажнение вдыхаемой кислородной смеси.
Продолжительность оксигенотерапии зависит от тяжести состояния больного и колеблется от 60 мин 3–4 раза в день до 14–16 ч в сутки. В некоторых случаях эффект может быть получен только через 3–4 недели ежедневной оксигенотерапии.
Для получения кислорода могут использоваться так называемые концентраторы (пермеаторы), выделяющие кислород из воздуха. Они позволяют добиться концентрации кислорода во вдыхаемой смеси около 40–50% и могут использоваться в домашних условиях при необходимости длительной (в течение нескольких месяцев) оксигенотерапии.
При неэффективности самостоятельного дыхания кислородом и парциальном давлении СО2 в артериальной крови (РСО2) более 60 мм рт. ст. целесообразно использовать методы искусственной вспомогательной вентиляции легких.
В настоящее время доказана способность длительной оксигенотерапии эффективно снижать давление в легочной артерии, уменьшать признаки дыхательной и сердечной недостаточности и достоверно увеличивать продолжительность жизни больных с хроническим ЛС.
2. Улучшение бронхиальной проходимости является вторым обязательным условием снижения артериальной гипоксемии и гиперкапнии. В зависимости от характера основного патологического процесса в легких применяют различные бронходилататоры, отхаркивающие средства и муколитики.
Бронхолитикипо механизмам действия делят на три группы:
· стимуляторы b-адренергических рецепторов (сальбутамол, беротек, изадрин, алупент);
· холинолитики (атровент, тровентол);
· метилксантины (теофиллин, теопек, теодур и др.).
Применяются и комбинированные препараты: беродуал (беротек + атровент), эудур (теофиллин + тербуталин) и др.
Коррекция мукоцилиарного клиренса также оказывает существенное влияние на бронхиальную проходимость, вентиляцию легких и газовый состав крови. Перспективными считают лекарственные средства, улучшающие слизеобразование и стимулирующие образование сурфактанта (бромгексин), муколитики (калия йодид), щелочные ингаляции и т.п.
Выбор каждого из этих лекарственных средств зависит от характера основного патологического процесса в легких и должен учитывать возможность побочных эффектов, а также конкретные показания и противопоказания к назначению этих препаратов, подробно изложенные в последующих главах.
3. Антибиотикиостаются основным этиологическим средством лечения бронхолегочной инфекции у больных хроническим ЛС. Адекватно подобранная неспецифическая антибактериальная терапия в большинстве случаев приводит к уменьшению воспалительной реакции в бронхиальном дереве и легочной ткани, восстановлению вентиляции в легких и уменьшению легочной артериальной гипоксемии. Лечение проводится с учетом лекарственной чувствительности флоры возможных побочных эффектов, в том числе кардиотоксического действия антибиотиков (см. ниже).
 Запомните
Длительная оксигенотерапия, адекватное применение бронходилататоров и антибиотиков способствует уменьшению признаков дыхательной и сердечной недостаточности и удлиняет жизнь больных ЛС. Уменьшение артериальной гипоксемии, гиперкапнии и ацидоза способствует снижению вазоконстрикции легочных артериол и давления в легочной артерии. Запомните
Длительная оксигенотерапия, адекватное применение бронходилататоров и антибиотиков способствует уменьшению признаков дыхательной и сердечной недостаточности и удлиняет жизнь больных ЛС. Уменьшение артериальной гипоксемии, гиперкапнии и ацидоза способствует снижению вазоконстрикции легочных артериол и давления в легочной артерии.
|
Коррекция легочного сосудистого сопротивления
Вторым направлением лечения больных с хроническим ЛС является применение некоторых медикаментозных средств, снижающих повышенное легочное сосудистое сопротивление (величину постнагрузки на ПЖ), приток крови к правым отделам сердца (уменьшение преднагрузки), объем циркулирующей крови (ОЦК) и давление в легочной артерии. С этой целью используют следующие препараты:
· блокаторы медленных кальциевых каналов;
· ингибиторы АПФ;
· нитраты;
· a1-адреноблокаторы и некоторые другие лекарственные средства.
1. Блокаторы медленных кальциевых каналов (антагонисты кальция). Их эффективность при легочной АГ продемонстрирована в некоторых краткосрочных клинических и экспериментальных исследованиях (S. Rich, B. Brundage). Показано, что антагонисты кальция способствуют не только снижению тонуса сосудов малого круга кровообращения, но и расслаблению гладкой мускулатуры бронхов, уменьшают агрегацию тромбоцитов и повышают устойчивость миокарда к гипоксии.
Дозы антагонистов кальция подбирают индивидуально, в зависимости от величины давления в легочной артерии и переносимости препаратов. При умеренном повышении давления в легочной артерии, например, у больных с ЛС, развившемся на фоне хронических обструктивных болезней легких (ХОБЛ) или рецидивирующей тромбоэмболии, антагонисты кальция назначают в средних терапевтических дозах:
· нифедипин — 60–80 мг в сутки;
· дилтиазем — 360–420 мг в сутки;
· исрадипин (ломир) 5–10 мг в сутки.
Значительное повышение давления в легочной артерии у больных с первичной легочной гипертензией требует применения более высоких доз антагонистов кальция:
· нифедипин — 100–120 мг в сутки;
· дилтиазем — до 600 мг в сутки;
· исрадипин (ломир) до 20 мг в сутки.
Лечение начинают с минимальных переносимых доз препаратов, постепенно увеличивая их каждые 4–6 дней под контролем клинической картины заболевания, давления в легочной артерии и системного АД. Лечение проводят длительно, на протяжении 5–6 недель, если не возникают побочные эффекты препаратов. Тем не менее в 30–40% случаев такое лечение оказывается неэффективным, что нередко указывает на наличие необратимых органических изменений сосудистого русла.
В целом применение антагонистов кальция у больных ЛС требует осторожности, в первую очередь, из-за возможного критического снижения системного АД и некоторых других нежелательных эффектов этих лекарственных средств.
2. Ингибиторы АПФ. Эти препараты, обладающие уникальными фармакологическими свойствами, в последние годы все шире используются для лечения больных с хроническим ЛС, прежде всего пациентов с признаками сердечной декомпенсации. Воздействие ингибиторов АПФ на легочное сосудистое сопротивление объясняется несколькими важными эффектами, подробно рассмотренными в главе 2. Напомним, что воздействие ингибиторов АПФ на гуморальную (эндокринную) РААС и уменьшение под их влиянием образования циркулирующего АII имеет несколько важных последствий.
· Расширение сосудов (артериол и вен), которое обусловлено, прежде всего, уменьшением сосудосуживающих влияний самого АII, а также угнетением инактивации одного из наиболее мощных вазодилататоров организма — брадикинина. Последний, в свою очередь, стимулирует секрецию эндотелиальных факторов расслабления (PGI2, NO, ЭГПФ), также обладающих выраженным вазодилатирующим и антиагрегантным эффектами. В результате происходит не только системная артериальная вазодилатация, но и снижается легочное сосудистое сопротивление. Кроме того, венозная дилатация, развивающаяся под действием ингибиторов АПФ, способствует уменьшению притока крови к правому сердцу, снижению давления наполнения и, соответственно, величины преднагрузки на ПЖ.
· Под действием ингибиторов АПФ уменьшается синтез альдостерона в надпочечниках, что сопровождается снижением альдостеронзависимой реабсорбции Nа+ и воды в дистальных канальцах почек. Одновременно уменьшается секреция ионов К+.
· Снижая содержание циркулирующего АII, ингибиторы АПФ уменьшают ангиотензинзависимую реабсорбцию Nа+ и воды в проксимальных канальцах. Таким образом, происходящее под действием ингибиторов АПФ уменьшение задержки Nа+ и воды также ведет к уменьшению ОЦК и величины преднагрузки.
· Наконец, ингибиторы АПФ подавляют стимулированное ангиотензином II образование норадреналина и, соответственно, снижают активность САС.
В результате этих и некоторых других эффектов ингибиторов АПФ уменьшается величина пред- и постнагрузки на ПЖ, ОЦК и снижается повышенное давление в легочной артерии.
У больных ЛС с признаками сердечной декомпенсации ингибиторы АПФ назначают в относительно небольших дозах:
· каптоприл 12,5–25 мг в сутки;
· эналаприл 5–10 мг в сутки;
· периндоприл (престариум) — 2 мг в сутки и т.д.
У больных с компенсированным ЛС рекомендуют более высокие суточные дозы препаратов:
· каптоприл до 50–75 мг в сутки;
· эналаприл 20–40 мг в сутки;
· периндоприл (престариум) — 4–8 мг в сутки и т.д.
Все же следует иметь в виду, что ингибиторы АПФ оказывают выраженное дилатирующее действие, прежде всего, на сосуды большого круга кровообращения, поэтому лечение может сопровождаться системной артериальной гипотензией. Следует также учитывать и другие нежелательные эффекты препаратов и противопоказания к их использованию.
3. Нитраты. Эти препараты относятся к вазодилататорам преимущественно венозного типа. Благодаря своим фармакологическим свойствам, нитраты существенно уменьшают венозный возврат крови к правому сердцу, “разгружая” малый круг кровообращения и снижая тем самым давление в легочной артерии. Чаще используют пролонгированные препараты изосорбид-динитрата или изосорбид-5-мононитрата, предназначенные для приема внутрь (см. главу 5).
Применение нитратов оказывается эффективным примерно у половины больных с хроническим ЛС, хотя у части больных может развиваться артериальная гипотензия или толерантность к приему препаратов (подробнее см. главу 4).
4. a1-адреноблокаторы. Действие этих веществ заключается в селективной блокаде a1-адренорецепторов гладкомышечных клеток сосудов, что способствует значительной артериолярной и венозной вазодилатации, снижению ОПСС и легочного сосудистого сопротивления. Кроме того, дилатация вен сопровождается депонированием крови в емкостных сосудах, уменьшением притока крови к сердцу и величины преднагрузки на ПЖ.
Учитывая возможность тяжелых гипотензивных (в том числе ортостатических) реакций при приеме a1-адреноблокаторов, для лечения больных хроническим ЛС рекомендуют использовать минимальные суточные дозы этих препаратов. С этой целью лучше использовать новый высокоспецифичный a1-адреноблкатор доксазозин, который в отличие от празозина может приниматься 1 раз в сутки в дозе 0,5–2 мг. Помимо выраженного вазодилатирующего действия, доксазозин снижает агрегацию тромбоцитов и повышает фибринолитическую активность крови, а также благоприятно действует на липидный профиль, повышая содержание ЛВП и снижая ХС ЛНП и триглицериды.
Следует все же иметь в виду, что длительное применение у больных ЛС a1-адреноблокаторов в реальной клинической практике часто наталкивается на серьезные трудности, в основном из-за побочных эффектов этих препаратов. Лучшие результаты получают у больных с сопутствующей эссенциальной АГ.
Критически оценивая результаты лечения вазодилататорами больных хроническим ЛС, необходимо отметить следующее. Несмотря на то что при однократном применении этих препаратов в большинстве случаев удается достоверно снизить давление в легочной артерии, эффективность курсового назначения этих лекарственных средств все же существенно ниже, чем эффективность длительной низкопоточной оксигенотерапии и/или адекватного противовоспалительного лечения бронхолегочных заболеваний. Пока не получено убедительных доказательств того, что длительное лечение вазодилататорами увеличивает продолжительность и улучшает качество жизни больных хроническим ЛС.
Следует также помнить, что в отдельных случаях применение вазодилататоров может даже усугублять нарушения газообмена в легких. Например, эффективное снижение тонуса легочных артериол и увеличение кровотока в участках легких, пораженных воспалительным или фиброзирующим процессом, иногда может ухудшать вентиляционно-перфузионные соотношения в этих областях, особенно, если терапия вазодилататорами не подкрепляется адекватной коррекцией нарушений легочной вентиляции. Это приводит к усугублению артериальной гипоксемии и активирует механизм гипоксической легочной вазоконстрикции. В результате давление в легочной артерии может повыситься еще больше.
В некоторых случаях уменьшение легочного сосудистого сопротивления, наступающее под действием вазодилататоров, и снижение величины постнагрузки на ПЖ могут сопровождаться увеличением МО (естественно, при сохраненной систолической функции ПЖ), что является одним из факторов, способствующих повышению давления в легочной артерии. Этому способствует также рефлекторная тахикардия, развивающаяся при лечении некоторыми вазодилататорами. Наконец, следует также иметь в виду возможность критического падения системного АД под действием этих препаратов.
Таким образом, лечение антагонистами кальция, ингибиторами АПФ, нитратами и a1-адреноблокаторами больных хроническим ЛС следует проводить с большой осторожностью, желательно под контролем не только системного АД и ЧСС, но и давления в легочной артерии, ОЦК и функционального состояния легких. Применение этих лекарственных средств имеет смысл только на фоне адекватной коррекции нарушений легочной вентиляции и лечения бронхолегочных заболеваний.
 Запомните
1. У больных с хроническим ЛС с целью снижения легочного сосудистого сопротивления и давления в легочной артерии могут использоваться вазодилататоры: блокаторы медленных кальциевых каналов, ингибиторы АПФ, нитраты и a1-адреноблокаторы. 2. Применение вазодилататоров у больных с хроническим ЛС требует большой осторожности и адекватного контроля за гемодинамикой и функциональным состоянием легких, поскольку в некоторых случаях назначение этих лекарственных средств может ухудшить вентиляционно-перфузионные соотношения в легких, что способствует росту давления в легочной артерии. 3. Лечение вазодилататорами должно сопровождаться адекватной коррекцией нарушений легочной вентиляции и лечением бронхолегочных заболеваний (длительная оксигенотерапия, применение антибиотиков, бронхолитиков и т.п.). Без такой комплексной терапии длительное применение вазодилататоров у больных ХОБЛ и ЛС практически не влияет на продолжительность и качество жизни больных. Запомните
1. У больных с хроническим ЛС с целью снижения легочного сосудистого сопротивления и давления в легочной артерии могут использоваться вазодилататоры: блокаторы медленных кальциевых каналов, ингибиторы АПФ, нитраты и a1-адреноблокаторы. 2. Применение вазодилататоров у больных с хроническим ЛС требует большой осторожности и адекватного контроля за гемодинамикой и функциональным состоянием легких, поскольку в некоторых случаях назначение этих лекарственных средств может ухудшить вентиляционно-перфузионные соотношения в легких, что способствует росту давления в легочной артерии. 3. Лечение вазодилататорами должно сопровождаться адекватной коррекцией нарушений легочной вентиляции и лечением бронхолегочных заболеваний (длительная оксигенотерапия, применение антибиотиков, бронхолитиков и т.п.). Без такой комплексной терапии длительное применение вазодилататоров у больных ХОБЛ и ЛС практически не влияет на продолжительность и качество жизни больных.
|
Коррекция гемореологических нарушений и агрегации тромбоцитов
Повышение вязкости крови, агрегации тромбоцитов и свертываемости крови, характерное для больных хроническим ЛС, оказывает существенное влияние на легочное сосудистое сопротивление и прогноз. Кроме того, в тяжелых случаях эти нарушения ведут к развитию вторичных тромбозов мелких ветвей легочной артерии, что также способствует прогрессированию легочной АГ. Это оправдывает использование некоторых способов коррекции гемореологических нарушений и повышенной агрегации тромбоцитов, особенно у пациентов с высокими цифрами давления в легочной артерии. К числу таких методов относятся:
· Кровопускание по 200–300 мл крови. Оно показано при увеличении гематокрита больше 55–60% и высоком давлении в легочной артерии. Хотя однократное кровопускание на время улучшает состояние больного, повторные процедуры редко приводят к стабилизации уровня давления в легочной артерии.
· Низкомолекулярные гепарины. Лечение низкомолекулярными гепаринами (например, фраксипарином по 0,6 2 раза в сутки подкожно) в первую очередь показано больным ЛС, развившемся на фоне рецидивирующей тромбоэмболии мелких ветвей легочной артерии. В поддерживающих дозах фраксипарин может использоваться у больных ЛС до 3–6 месяцев. Менее эффективным оказывается назначение гепарина по 5000 ЕД 2 раза в день подкожно.
· Реополиглюкин внутривенно капельно по 200–400 мл 2 раза в неделю.
· Трентал внутрь по 100–400 мг 2–3 раза в день.
Особенности лечения правожелудочковой недостаточности
При развитии декомпенсированного ЛС с признаками правожелудочковой недостаточности применяют диуретики, ингибиторы АПФ и в некоторых случаях — сердечные гликозиды.
Диуретикипоказаны при появлении клинических признаков правожелудочковой недостаточности, в частности, при наличии отечного синдрома и высоких значений ОЦК. Обычно используют сильнодействующие петлевые диуретики (подробнее — см. главу 2). Эти препараты целесообразно сочетать с приемом калийсберегающих диуретиков или антагонистов альдостерона (альдактона, верошпирона и др.). Лечение начинают с малых суточных доз. Дозу препарата подбирают индивидуально. Медленное постепенное увеличение дозы мочегонных (“титрование дозы”) в большинстве случаев позволяет избежать резкого уменьшения ОЦК и снижения системного АД.
Следует также помнить, что неконтролируемое применение мощных диуретиков у больных ЛС может вызвать метаболический алкалоз, который способствует усугублению гиперкапнии. Последняя, как известно, снижает чувствительность дыхательного центра к СО2, что ведет к еще большему ухудшению легочной вентиляции и, как следствие, к возрастанию давления в легочной артерии.
Сердечные гликозиды. Необходимость применения этих лекарственных средств у больных декомпенсированным ЛС ограничена, прежде всего, случаями, осложненными фибрилляцией предсердий и сопутствующей левожелудочковой недостаточностью (например, у пациентов, страдающих ИБС). Используют, как правило, малые дозы гликозидов, например, дигоксин по 0,25 мг 1 раз в день.
В остальных случаях сердечные гликозиды у больных ЛС, как правило, малоэффективны, поскольку они не воздействуют на основной механизм развития легочной АГ — легочное сосудистое сопротивление. Мало того, увеличение под действием сердечных гликозидов ударного выброса ПЖ является фактором, повышающим уровень давления в легочной артерии. Следует также учитывать, что лечение сердечными гликозидами больных хроническим ЛС особенно часто сопровождается развитием гликозидной интоксикации и нарушениями сердечного ритма. Поэтому на длительный срок эти лекарственные средства больным, как правило, не назначаются.
Ингибиторы АПФ. Длительное применение этих лекарственных препаратов у больных с декомпенсированным ЛС в целом имеет большие преимущества перед другими способами лечения правожелудочковой недостаточности. Ингибиторы АПФ способны оказывать влияние не только на основные звенья патогенеза сердечной недостаточности, вызывая гемодинамическую и нейрогормональную “разгрузку” сердца, но и положительно влиять на уровень давления в легочной артерии (см. выше). Имеются сообщения о том, что длительное применение ингибиторов АПФ у больных декомпенсированным ЛС сопровождается замедлением прогрессирования сердечной недостаточности, снижением летальности, улучшением прогноза и качества жизни больных.
Механизмы положительного влияния ингибиторов АПФ на состояние больных с сердечной недостаточностью подробно обсуждались в главе 2. Напомним, что эффективность применения этих препаратов при сердечной декомпенсации связана, прежде всего, с устранением активации тканевых РАС и выражается в следующих положительных реакциях:
· замедление процессов ремоделирования сердца, сосудов и других органов;
· обратное развитие гипертрофии миокарда желудочков;
· предотвращение прогрессирования дилатации ПЖ;
· замедление формирования интерстициального фиброза миокарда;
· снижение диастолической ригидности ПЖ.
Кроме того, ингибиторы АПФ, воздействуя на гуморальную (эндокринную) РААС и угнетая образование циркулирующего ангиотензина II, способствуют выраженной гемодинамической разгрузке сердца и снижению величины пред- и постнагрузки на ПЖ. Эти эффекты ингибиторов АПФ обеспечиваются:
· системной вазодилатацией артериол (уменьшение постнагрузки) и вен (уменьшение преднагрузки);
· уменьшением синтеза альдостерона в надпочечниках и снижением реабсорбции Nа+ и воды в дистальных канальцах почек (снижение ОЦК и величины преднагрузки);
· уменьшением активности САС.
Применение ингибиторов АПФ у больных декомпенсированным ЛС требует соблюдения тех же принципов лечения, рекомендованных Европейским обществом кардиологов (1997), которые были изложены в главе 2. Для лечения используют современные препараты II и III поколений, начальные и поддерживающие дозы которых представлены в табл. 13.2.
Таблица 13.2
Начальная и поддерживающая дозы ингибиторов АПФ при лечении больных декомпенсированным легочным сердцем
| Препарат | Начальная доза, мг в сутки | Поддерживающая доза, мг в сутки |
| Беназеприл | 2,5 | до 5–10 |
| Каптоприл | 18,75 (в 3 приема) | до 50–75 (в 3 приема) |
| Эналаприл | 2,5 | до 10–20 (в 2 приема) |
| Лизиноприл | 2,5 | до 5–20 (1 раз в сутки) |
| Квинаприл | 2,5–5 | до 10–20 (в 2 приема) |
| Периндоприл | ||
| Рамиприл | 1,25–2,5 | 2,5–5 |
При длительном лечении ингибиторами АПФ необходимо также учитывать возможные побочные эффекты этих препаратов и соблюдать описанные ранее меры предосторожности (см. главу 2).
Таким образом, комплексное лечение больных хроническим ЛС должно предусматривать адекватную терапию основного заболевания, коррекцию легочной артериальной гипоксемии, воздействие на гемореологические показатели, агрегацию тромбоцитов и свертываемость крови, гемодинамическую и нейрогормональную “разгрузку” сердца и острожное применение вазодилататоров, снижающих давление в легочной артерии.
Прогноз
Прогноз в большинстве случаев зависит от характера и тяжести основного заболевания бронхолегочной системы. Наиболее серьезный прогноз имеют пациенты с первичной легочной АГ и рецидивирующими тромбоэмболиями мелких ветвей легочной артерии. Продолжительность жизни больных декомпенсированным ЛС с признаками прогрессирующей правожелудочковой недостаточности и отечным синдромом обычно не превышает 2,5–5 лет.
| Глава 14. Тромбоэмболия легочной артерии и острое легочное сердце |

|
Тромбоэмболия легочной артерии (ТЭЛА) — это окклюзия просвета основного ствола или ветвей легочной артерии частичками тромба, сформировавшегося в венах большого круга кровообращения или полостях правого сердца, переносимыми в малый круг кровообращения с током крови. Механическая закупорка ствола или ветвей легочной артерии тромбоэмболом сопровождается генерализованным спазмом легочных артериол, что приводит к резкому ограничению кровотока в легких.
ТЭЛА — распространенное и прогностически весьма неблагоприятное осложнение различных заболеваний, травм и оперативных вмешательств. ТЭЛА занимает третье место среди причин смерти населения (после других сердечно-сосудистых заболеваний и злокачественных новообразований). На аутопсии ее выявляют в 7–10% случаев всех патологоанатомических вскрытий. Причем легочная тромбоэмолия при жизни не диагностируется более чем у 1/2 больных. Летальность при возникновении ТЭЛА составляет около 30%, хотя на фоне адекватной и своевременно начатой терапии она снижается до 10%.
| 14.1. Этиология |

|
Наиболее частой причиной ТЭЛА является острый тромбоз глубоких вен илеофеморального сегмента. Гораздо реже источником ТЭЛА служат тромбозы глубоких вен голеней. К относительно редким причинам ТЭЛА относятся тромбозы венозных сплетений таза, пристеночные тромбы в полостях правого сердца. Тромбофлебиты поверхностных вен почти никогда не осложняются ТЭЛА.
Следует отметить, что ТЭЛА развивается не во всех случаях острого тромбоза глубоких вен. Например у больных с тромбозами илеофеморальных вен ТЭЛА возникает в половине случаев, а при тромбозе глубоких вен голеней — только в 1–5% случаев. Отрываются и переносятся с током крови в малый круг кровообращения главным образом так называемые флотирующие тромбы, имеющие единственную точку фиксации в своем дистальном отделе. Длина таких тромбов достигает иногда 15–20 см. При тромбах, окклюзирующих просвет сосуда, ТЭЛА не развивается.
В таблице 14.1 перечислены основные факторы, способствующие возникновению тромбоза магистральных вен и, соответственно, ТЭЛА. В первую очередь к ним относятся злокачественные новообразования (около 30% случаев ТЭЛА), которые, как известно, сопровождаются синдромом гиперкоагуляции и угнетением системы фибринолиза.
Одним из ведущих факторов, способствующих тромбообразованию в глубоких венах нижних конечностей, является гиподинамия. Значительное уменьшение работы мышц нижних конечностей приводит к замедлению кровотока в венах, что способствует образованию там тромбов. Особенно опасна гиподинамия у лиц пожилого и старческого возраста, у больных, вынужденных соблюдать постельный режим (ИМ, инсульт, ХСН, переломы костей и т.п.) или страдающих хронической венозной недостаточностью нижних конечностей. Нередко ТЭЛА осложняет течение послеоперационного периода (операции на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно если имеются гнойные осложнения этих операций.
Таблица 14.1
Факторы, способствующие возникновению тромбоза глубоких вен нижних конечностей
| Злокачественные новообразования |
| Гиподинамия, в том числе необходимость соблюдения постельного режима |
| Переломы костей или травмы ног |
| Хирургические вмешательства, в первую очередь на органах брюшной полости и нижних конечностях |
| Пожилой и старческий возраст |
| Хроническая сердечная недостаточность |
| Ожирение |
| Сахарный диабет |
| Прием пероральных контрацептивов |
| Хроническая венозная недостаточность нижних конечностей |
| Первичные гиперкоагуляционные состояния |
| Эритремия |
| Системная красная волчанка |
| Наследственные факторы (дефицит антитромбина III, протеинов С и S, дисфибриногенемия, гомоцистеинурия и др.) |
 Запомните
1. Около 70% случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Тромбофлебит поверхностных вен почти никогда не сопровождается ТЭЛА. 2. К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся: Запомните
1. Около 70% случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Тромбофлебит поверхностных вен почти никогда не сопровождается ТЭЛА. 2. К числу наиболее распространенных факторов, способствующих тромбообразованию в магистральных венах, относятся:
|
14.2. Патогенез
| 14.2.1. Механизмы обструкции легочно-артериального русла |

|
Патогенез гемодинамических и вентиляционных расстройств при ТЭЛА чрезвычайно сложен (рис. 14.1). Ведущим фактором в генезе гемодинамических расстройств при ТЭЛА является механическая обструкция легочно-артериального русла. Причем тромб, оторвавшийся от места своего образования, например в глубоких венах нижних конечностей, и переносимый с током крови в малый круг кровообращения, частично разрушается. Поэтому в большинстве случаев имеет место множественная окклюзия нескольких ветвей легочной артерии разного калибра, часто двусторонняя (немассивная ТЭЛА). В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола легочной артерии, которая, как правило, сопровождается острым (без предвестников) развитием тяжелейшей клинической картины тромбоэмболии, в том числе быстро наступающей внезапной сердечной смертью. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви легочной артерии.

|
| Рис. 14.1. Схема патогенеза острого легочного сердца при тромбоэмболии легочной артерии |
Наряду с механической частичной или полной закупоркой легочно-артериального русла тромбоэмболом происходит резко выраженный генерализованный спазм артериол малого круга, во многом обусловленный высвобождением из тромбоцитов, оседающих на поверхности тромбоэмбола, вазоконстрикторных субстанций (тромбоксана А2, серотонина, гистамина и др.). В результате легочное сосудистое сопротивление возрастает в еще большей степени. Это объясняет частое несоответствие между объемом эмболической окклюзии легочных сосудов и тяжестью клинической картины ТЭЛА.
Следует также помнить, что при ТЭЛА степень окклюзии просвета сосуда со временем может увеличиваться за счет присоединения вторичного местного тромбоза, который увеличивает размеры тромбоэмбола в проксимальном направлении, т.е. против тока крови. Нередко это приводит к трансформации немассивной ТЭЛА в массивную (рис. 14.2).
 Запомните
Ведущим фактором, определяющим степень гемодинамических расстройств и нарушения вентиляционно-перфузионных соотношений при ТЭЛА, является обструкция легочно-артериального русла, степень которой зависит от: Запомните
Ведущим фактором, определяющим степень гемодинамических расстройств и нарушения вентиляционно-перфузионных соотношений при ТЭЛА, является обструкция легочно-артериального русла, степень которой зависит от:
|
| Рис. 14.2. Увеличение окклюзии ветви легочной артерии за счет вторичного тромбозирования эмбола. а — первоначальная эмболия одной из мелких ветвей ЛА; б — образование вторичного местного тромба, увеличивающего размеры обструкции ветвей ЛА | 
| ||
| 14.2.2. Гемодинамические последствия тромбоэмболии легочной артерии | |||

| |||
Полное или частичное прекращение легочного кровотока в результате тромбоэмболии легочной артерии приводит к двум основным следствиям, определяющим клиническую картину заболевания и судьбу больного (рис. 14.3):
1. Выраженному нарушению вентиляционно-перфузионных отношений, что приводит к возникновению дыхательной недостаточности и артериальной гипоксемии.
2. Формированию легочной артериальной гипертензии, которая, в свою очередь, является причиной резкого падения МО и системного АД, а также к развитию острой правожелудочковой недостаточности (острого легочного сердца).
Дыхательная недостаточность и артериальная гипоксемия возникают, прежде всего, в результате прекращения кровотока в хорошо вентилируемых альвеолах, что приводит к увеличению внутрилегочного “мертвого пространства” и ухудшению газообмена. Нарушение вентиляционно-перфузионных отношений усугубляется выраженным бронхоспазмом, связанным с действием на гладкую мускулатуру мелких бронхов биологически активных веществ, выделяющихся из тромбоцитов (тромбоксан А2, серотонин и др.). Кроме того, в результате ишемии альвеол, обусловленной их недостаточной перфузией, нарушается не только их вентиляция, но и выработка сурфактанта, что уже спустя 1–2 суток после тромбоэмболии может привести к развитию ателектазов. Вследствие недостаточности кровоснабжения альвеол может развиться инфаркт легкого. Кроме того, снижение вентиляции хорошо перфузируемых альвеол еще больше нарушает газообмен в легких и приводит к усугублению артериальной гипоксемии. Наконец, в результате повышения давления проксимальнее области окклюзии открываются артериоло-венозные анастомозы и происходит шунтирование крови из артериол в вены, что также усугубляет артериальную гипоксемию.
Вторым следствием окклюзии ветвей легочной артерии является легочная АГ. Она обусловлена как самой механической окклюзией сосудистого русла тромбоэмболом, так и генерализованным спазмом легочных артериол. В результате повышается легочное сосудистое сопротивление на фоне значительного уменьшения емкости артериального русла. Это приводит к значительному ограничению венозного притока крови в левые отделы сердца и развитию синдрома малого сердечного выброса: уменьшаются МО, СИ, уровень АД, нарушается кровоснабжение жизненно важных органов (головного мозга, сердца, почек). В тяжелых случаях могут развиться признаки так называемого обструктивного шока, включая потерю сознания (синкопе), значительное снижение АД, уменьшение диуреза, стенокардию и т.д.
| Рис. 14.3. Схема гемодинамических расстройств при тромбоэмболии легочной артерии | 
|
Кроме того, значительные цифры давления в легочной артерии и увеличение постнагрузки на ПЖ может приводить к быстрому развитию острого легочного сердца. Повышается систолическое и конечно-диастолическое давление в ПЖ, ПП, желудочек и предсердие дилатируются и возникает застой крови в венозном русле большого круга кровообращения.
 Запомните
Для острой ТЭЛА характерно два нарушения гемодинамики и альвеолярной вентиляции: 1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
· прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного “мертвого пространства”;
· бронхоспазм;
· развитие ателектазов;
· ишемия легкого и снижение вентиляции;
· артериоло-венозное шунтирование крови.
2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
· синдром малого сердечного выброса, сопровождающийся снижением МО, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек);
· острая правожелудочковая недостаточность с подъемом КДД ПЖ, ЦВД и (в тяжелых случаях) застоем крови в венах большого круга кровообращения. Запомните
Для острой ТЭЛА характерно два нарушения гемодинамики и альвеолярной вентиляции: 1. Дыхательная недостаточность и артериальная гипоксемия, причинами которых являются:
· прекращение кровотока по вентилируемым альвеолам, что приводит к увеличению внутрилегочного “мертвого пространства”;
· бронхоспазм;
· развитие ателектазов;
· ишемия легкого и снижение вентиляции;
· артериоло-венозное шунтирование крови.
2. Легочная АГ, возникающая в результате механической окклюзии сосудистого русла и генерализованного спазма артериол. Следствием повышенного давления в легочной артерии являются:
· синдром малого сердечного выброса, сопровождающийся снижением МО, АД и нарушением кровоснабжения жизненно важных органов (головного мозга, сердца, почек);
· острая правожелудочковая недостаточность с подъемом КДД ПЖ, ЦВД и (в тяжелых случаях) застоем крови в венах большого круга кровообращения.
|
Следует подчеркнуть, что далеко не всегда при ТЭЛА присутствуют все описанные нарушения гемодинамики и альвеолярной вентиляции. Это зависит прежде всего от массивности тромбоэмболии, а также от локализации тромбоэмбола. Наиболее яркие клинические проявления ТЭЛА возникают, когда острое ограничение легочного кровотока достигает 60% от объема всего сосудистого русла легких.
| 14.3. Клиническая картина |

|
Клиническая картина заболевания определяется объемом эмболизации легочного сосудистого русла, локализацией тромбоэмбола, уровнем легочной АГ, степенью гемодинамических расстройств и другими факторами.
С практической точки зрения очень удобно деление ТЭЛА на два варианта:
- массивную и субмассивную ТЭЛА;
- немассивную ТЭЛА.
Массивная и субмассивная ТЭЛА обусловлена тотальной или субтотальной окклюзией крупной проксимальной ветви или ствола легочной артерии; протекает остро, с бурной клинической симптоматикой и часто заканчивается внезапной смертью. Считают, что в отдельных случаях массивная ТЭЛА может развиться в результате распространенной множественной эмболии более мелких ветвей легочной артерии вследствие предшествующих изменений в легких. Немассивная ТЭЛА связана с эмболией мелких ветвей легочной артерии.
| 14.3.1. Массивная и субмассивная ТЭЛА |

|
Клиническая картина тромбоэмболии ствола или крупных ветвей легочной артерии в большинстве случаев характеризуется острым началом заболевания, бурным прогрессированием симптомов эмболии, развитием дыхательной и правожелудочковой недостаточности, падением АД и нарушением перфузии внутренних органов.
 Запомните
Массивная и субмассивная ТЭЛА, если она не приводит к быстрому летальному исходу, может сопровождаться развитием нескольких синдромов:
· дыхательной недостаточности;
· инфаркта легкого или инфарктной пневмонии;
· плеврита (сухого или экссудативного, в том числе геморрагического);
· острого легочного сердца;
· артериальной гипотонии;
· нарушением перфузии внутренних органов. Запомните
Массивная и субмассивная ТЭЛА, если она не приводит к быстрому летальному исходу, может сопровождаться развитием нескольких синдромов:
· дыхательной недостаточности;
· инфаркта легкого или инфарктной пневмонии;
· плеврита (сухого или экссудативного, в том числе геморрагического);
· острого легочного сердца;
· артериальной гипотонии;
· нарушением перфузии внутренних органов.
|
Жалобы
Массивная ТЭЛА, как правило, начинается с внезапного появления “необъяснимой” одышки в покое. Число дыхательных движений увеличивается до 20–30 в мин и более. Столь же часто (примерно в 85–90% случаев) появляются боли в грудной клетке. Они чаще локализуются за грудиной, напоминая ангинозные боли при ИМ. Нередко боли носят характер острых плевральных болей, усиливающихся при дыхании, кашле и об