 |
|
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Образование названий комплексных соединений осуществляется согласно следующим правилам:
1. Порядок перечисления частиц.
Если соединение является комплексной солью, то его название будет состоять из двух слов: сначала называется анион в именительном падеже, а затем катион в родительном падеже.
Если внутренняя сфера – катион, то для названия комплексообразователя используют русский корень элемента, а если внутренняя сфера – анион, то в названии применяют латинский корень. Степень окисления комплексообразователя указывается в скобках римской или арабской цифрой.
У нейтральных комплексов (без внешней сферы) название состоит из одного слова в именительном падеже с использованием русского корня комплексообразователя, при этом его степень окисления не указывается.
При названии комплексного иона сначала указываются лиганды, затем комплексообразователь. Перечисление лигандов следует вести в следующем порядке:
1) анионы – ОН–, одноатомные, полиатомные;
2) нейтральные лиганды сначала неорганические, затем органические;
3) катионы в любом порядке.
Записанная формула читается справа налево, а при составлении формулы по её названию в квадратных скобках сначала записывают комплексообразователь, а затем лиганды в обратном порядке их перечисления.
Например,
K3[Fe(CN)6] – гексацианоферрат (III) калия;
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина;
2. Названия лигандов.
Для нейтральных лигандов используют однословные названия веществ без изменений. Например: N2 – диазот, N2H4 – гидразин, C2H4 - этилен. Для молекул Н2О, NH3, СО, NO применяют особые термины: аква, аммин, карбонил, нитрозил соответственно.
К названиям анионных лигандов прибавляют соединительную гласную -о-. Например: Cl– – хлоро, SO  – сульфато, О2– – оксо, S2– – тио, ОН– – гидроксо, CN– – циано, NСS– – тиоцианато, Н– – гидридо, NO
– сульфато, О2– – оксо, S2– – тио, ОН– – гидроксо, CN– – циано, NСS– – тиоцианато, Н– – гидридо, NO  – нитро, NO
– нитро, NO 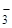 – нитрато и т.д. Исключение составляют анионы углеводородов, например С5Н
– нитрато и т.д. Исключение составляют анионы углеводородов, например С5Н  – циклопентадиенил.
– циклопентадиенил.
Громоздкие по написанию формулы органических лигандов заменяют буквенными обозначениями:
1) NH2CH2CH2NH2 (этилендиамин) – Еn;
2) C5H5N (пиридин) – py;
3) (NH2)2CO (карбамид) – ur;
4) NH2CH2COO– (глицинат-ион) – gly;
5) С6Н3(ОН)(СООН)SO  (ион сульфосалициловой кислоты) – sal.
(ион сульфосалициловой кислоты) – sal.
3. Приставки и окончания.
Число простых лигандов указывают с помощью приставок греческих числительных: ди-2, три-3, тетра-4, пента-5, гекса-6, гепта-7, окта-8, нона-9, дека-10, ундека-11, додека-12.
Для лигандов со сложными названиями, в которых уже имеются приставки (моно-, ди-…) используют приставки бис-2, трис-3, тетракис-4, а названия таких лигандов заключаются в круглые скобки.
Для названия анионных комплексов применяют окончания: -ат, если КС относится к классу солей; -овая или -ная, если КС является кислотой. Для катионных и нейтральных комплексов типичных окончаний нет.
Например:
[Fe(Еn)3]Cl3 – хлорид трис(этилендиамин)железа (+3);
[Pt(Еn)(NH3)2(NO2)Cl]SO4 – сульфат хлоронитродиамминэтилендиамин-платины (IV);
H2[SiF6] – гексафторокремниевая кислота.
Для развёрнутых формул многоядерных комплексов названия строятся следующим образом:
[(CO)5Mn-Mn(CO)5] – бис(пентакарбонилмарганец)( Mn-Mn);
K2[Cl4Re-ReCl4] – бис(тетрахлороренат(III)) калия.
Если известно, каким своим атомом сложный лиганд координирован комплексообразователем, то в названиях лигандов указывают символ этого атома:
[Co(–NCS)4]2– - тетракис(тиоцианато–N)кобальтат (II)-ион;
[Hg(–SCN)4]2– - тетракис(тиоцианато–S)меркурат(II)-ион.