 |
|
Теория поля лигандов
ТПЛ дополняет МВС, успешно объясняя электрические, магнитные и химические свойства большинства КС. В основе данной теории лежит положение, что связь между комплексообразователем и лигандами обусловлена только электростатическими эффектами, то есть является ионной или ион-дипольной. При этом не учитывается ковалентная природа связывания, возможность образования π–связей и строение лиганда. Согласно ТПЛ лиганды – заряженные точки, а комплексообразователь рассматривается с детальным учетом его электронной структуры.
В свободном атоме или ионе АО любого d–подуровня пятикратно вырождены, т.е. все пять АО имеют одинаковую энергию. Если такую частицу поместить в центре ориентированных особым образом лигандов, то под действием их электростатического поля энергия АО d–подуровня комплексообразователя изменится.
Вне зависимости от числа и расположения лигандов вокруг центрального иона АО d–подуровня расщепляются на две группы новых орбиталей:
1) de серию, образованную dxy, dxz, dyz электронными облаками;
2) dg серию, содержащую d  и d
и d 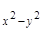 АО.
АО.
В октаэдрическом поле лигандов (КЧ = 6) электроны dg серии испытывают более сильное отталкивание со стороны лигандов, чем электроны dε серии, поэтому энергия dg серии более высокая (см. рис. 1).
 |

Рис.1. Расщепление d –АО в октаэдрическом поле лигандов
В тетраэдрическом поле лигандов (КЧ = 4) d–подуровень расщепляется по отношению к октаэдрическому полю в обратном порядке (см. рис.2).
 |

Рис.2. Расщепление d –АО в тераэдрическом поле лигандов
Сумма энергий АО dg и dε серий согласно закону сохранения энергии равна начальному значению энергии Е0 вырожденных орбиталей. Разность между энергиями новых подуровней  называют энергией (иначе параметром) расщепления.
называют энергией (иначе параметром) расщепления.
Величина энергии расщепления для данного комплексообразователя определяется природой лиганда. Для 3d–элементов экспериментально установлен так называемый спектрохимический ряд, в котором слева направо численное значение Δ монотонно возрастает:
I– < Br– < –SCN– < Cl– < NO 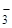 < F– < OH– < –ONO– < C2O
< F– < OH– < –ONO– < C2O  < H2O <
< H2O <
< –NCS– < gly < py < H– < NH3 < Еn < –NC– < NO  < CN– < CO
< CN– < CO
(подчеркнут атом, непосредственно связанный с комплексообразователем)
Лиганды левой части ряда называются лигандами слабого поля, так как вызывают малое расщепление энергии d‑подуровня. В этом случае величина Δ не превышает энергию взаимного отталкивания спаренных электронов, что приводит к заполнению АО электронами в соответствии с правилом Гунда (см. рис. 3).


 | |||
 |
Рис.3. Распределение электронов d –подуровня в ионе Co3+ при
октаэдрическом расположении лигандов слабого поля
Лиганды правой части ряда – лиганды сильного поля – приводят к значительному расщеплению энергии d–подуровня, при этом величина Δ превышает энергию межэлектронного отталкивания спаренных электронов. Это означает, что энергетически более выгодно заполнять электронами АО с нарушением правила Гунда. Например, в случае октаэдрического расположения лигандов сильного поля электроны будут заполнять сначала по одному, а затем по второму АО dε серии, а затем в таком же порядке АО dγ серии (см. рис.4). Для тетраэдрического поля порядок будет обратный.


Рис.4. Распределение электронов d –подуровня в ионе Co3+ при
октаэдрическом расположении лигандов сильного поля
ТПЛ также как и МВС позволяет объяснять магнитные свойства комплексов: при наличии неспаренных электронов – комплекс парамагнитен, а при их отсутствии – диамагнитен. Однако, в слабом октаэдрическом поле лигандов число неспаренных электронов всегда больше, чем в сильном. Поэтому комплексы с лигандами, создающими слабое октаэдрическое поле, называют высокоспиновыми, а с лигандами сильного поля –низкоспиновыми.
ОПТИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Если на dγ подуровне в случае октаэдрического поля лигандов (или на dε подуровне для тетраэдрического поля) есть вакантная (свободная) АО, то при поглощении комплексным ионом кванта света возможен переход электрона с нижнего энергетического подуровня на верхний (для октаэдрического поля это переход с dε подуровня на dγ). Такого рода переходы определяют наличие окраски у КС, так как энергия поглощаемого кванта света равна энергии расщепления. В расчете на 1 моль поглощающего вещества справедливо соотношение (Дж/моль)
 , (2)
, (2)
где h – постоянная Планка (h = 6,63×10–34 Дж×с); с – скорость света (с = 3×108 м/с); NА – постоянная Авогадро (NА = 6, 02×1023 моль–1); l – длина волны поглощаемого света, м.
При поглощении света с длиной волны, соответствующей определённой части спектра, вещество оказывается окрашенным в соответствующий цвет (см. табл. 1 приложения).
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду правее (т.е. обладающие большей силой поля), значение энергии расщепления Δ возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это изменяет его окраску.
Например, ион [Co(ONO)(NH3)5]2+ – красного цвета, а [Co(NO2)(NH3)5]2+ – желтого; у комплексов меди (II) при переходе от [CuCl4]2+ к [Cu(H2O)4]4+ и к [Cu(NH3)4]2+ цвет изменяется от зелёного через голубой на сине-фиолетовый.
Сила поля четырёх лигандов меньше силы октаэдрического поля, поэтому параметр расщепления тетраэдрическим полем всегда меньше, чем октаэдрическим. Для 3d-элементов с незаполненным 3d-подуровнем образование тетраэдрических комплексов происходит только в слабом поле лигандов (в сильном поле формируются плоскоквадратные комплексы, КЧ = 4). При конфигурации 3d10 всегда образуются тетраэдрические комплексы.