 |
|
Закон руху в релятивістській фізиці
Визначене другим законом Ньютона рівняння інваріантне щодо перетворень Галілея, але не є інваріантним щодо перетворень Лоренца. При створенні теорії відносності його довелося змінити. Виражене через 4-вектори друге рівняння Ньютона набирає вигляду
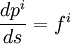 ,
,
де  — 4-імпульс, s — просторово-часовий інтервал,
— 4-імпульс, s — просторово-часовий інтервал,  — 4-вектор сили:
— 4-вектор сили:
 ,
,
де c — швидкість світла у вакуумі.
При малих швидкостях релятивістське рівняння руху переходить у друге рівняння Ньютона, але при великих швидкостях з'являються відмінності, завдяки яким рівняння є лоренц-інваріантним.
5Механі́чна ене́ргія — Фізична величина, яку фізичне тіло має завдяки своєму рухові чи перебуванні в полі потенціальних сил.
Механічна енергія дорівнює сумі кінетичної та потенціальної енергії тіла.
Поняття механічної енергії макроскопічного тіла не включає в себе енергію руху атомів, із яких воно складається.
Механічна робота - це фізична величина, що є скалярной кількісною мірою дії сили або сил на тіло або систему, що залежить від чисельної величини і напряму сили (сил) і від переміщення точки (точок) тіла або системи .
Потужність — робота, що виконана за одиницю часу, або енергія, передана за одиницю часу.
Зазвичай позначається латинською літерою W, вимірюється у Ватах. Іншою одиницею вимірювання, яка ще й досі широко використовується, є кінська сила.
Потужність є важливою характеристикою двигунів.
6Маса і розміри молекул
Для кількісної оцінки речовини користуються поняттям моля – одиниці кількості речовини. Моль – це така кількість речовини, в якій міститься стільки молекул (атомів чи іонів), скільки міститься атомів в 0,012 кг вуглецю 12С. Число молів Файл:142.png де т – маса речовини, М –маса моля (визначається За таблицею Менделєєва, наприклад, МN2 = 0,028 кг/моль). Авогадро встановив: 1.Число молекул у молі: NA = 6,02 . 1023 моль-1(стала Авогадро). 2.Об єм моля будь-якого газу при нормальних тиску і темперетурі:
Маса однієї молекули: 
Число Авогадро — кількість структурних одиниць (атомів, молекул або інших) в одному молі[1]. Назване так на честь Амедео Авогадро, автора закона Авогдаро.
Число Авогадро позначають NA, воно є однією з найважливіших сталих у фізиці і хімії.
Стала Авогадро дорівнює[2]
| NA = 6.02214129(27)×1023 моль−1 |
Число Авогадро визначене близько 20 незалежними один від одного методами. Результати цих вимірювань взагалі відповідають один одному, що є яскравим свідченням реальності молекул і молекулярної будови речовини. Знаючи число Авогадро й об'єм 1 грам-молекули (молярний об'єм), можна визначити кількість молекул в одиниці об'єму, тобто число Лошмідта.
7Рівн́яння стáну ідеáльного гáзу — формула, що встановлює залежність між тиском, молярним об'ємом і абсолютною температурою класичного ідеального газу. Рівняння має вигляд:
 , де:
, де:
-
 — тиск,
— тиск, -
 — молярний об'єм,
— молярний об'єм, -
 — абсолютна температура,
— абсолютна температура, -
 — універсальна газова стала.
— універсальна газова стала.
Оскільки  , де
, де  — кількість речовини, то рівняння можна записати у вигляді:
— кількість речовини, то рівняння можна записати у вигляді:


Останнє рівняння називають об'єднаним газовим законом. З нього випливають закони Бойля—Маріотта, Шарля і Гей—Люссака:
 — закон Гей-Люссака
— закон Гей-Люссака
 — закон Шарля (другий закон Гей-Люссака)
— закон Шарля (другий закон Гей-Люссака)
 — закон Бойля-Маріотта
— закон Бойля-Маріотта
Закон Бойля—Маріотта названий на честь ірландського фізика, хіміка і філософа Роберта Бойля (1627—1691), що відкрив його в 1662, а також на честь французького фізика Едма Маріотта (1620—1684), який відкрив цей закон незалежно від Бойля в 1676 році. Якщо записати  , де m — маса,
, де m — маса, 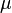 — молярна маса, рівняння стану виглядатиме так:
— молярна маса, рівняння стану виглядатиме так:

Ця форма запису носить назву рівняння (закона) Клапейрона—Менделєєва.
Інша форма запису, яка частіше використовується в статистичній фізиці:
 ,
,
де N — кількість частинок,  — стала Больцмана.
— стала Больцмана.
Її можна також переписати у вигляді
 ,
,
де n = N/V — густина частинок.
8Як відомо, речовина в рідкому стані зберігає свій об'єм,але набуває формипосудини,в якій вона розміщена.
Збереження об'єму рідини доводить, що між її молекулами діють сили притягання. Отже, відстані між молекулами рідини мають бути меншими за радіус молекулярної дії. Ці сили взаємодії утримують молекулу рідини біля її тимчасового положення рівноваги приблизно протягом 10-12 — 10-10 с, після чого вона перескакує в нове тимчасове положення рівноваги приблизно на відстань свого діаметра. Молекули рідини між перескоками здійснюють коливальний рух навколо тимчасового положення рівноваги.Час між двома перескоками молекули з одного положення в інше називається часом осілого життя. Цей час залежить від виду рідини і температури. При нагріванні рідини середній час осілого життя молекул зменшується.
Протягом часу осілого життя (порядку 10-11 с) більшість молекул рідини вдержується в своїх положеннях рівноваги, і лише невелика частина їх встигає за цей час перейти в нові положення рівноваги. За довший час уже більшість молекул рідини встигне змінити своє місцеположення. Томурідина має текучістьі набуває форми посудини, в якій вона міститься.
Якщо в рідині виділити дужемалий об'єм, топротягом часуосілого життя вньому існує упорядковане розміщеннямолекул, подібне доїх розміщення вкристалічній решітцітвердого тіла.Потім воно розпадається, алевиникає в іншому місці. Таким чином, увесь простір,зайнятий рідиною, ніби складається збезлічі зародків кристалів, які,проте, нестійкі, тобто розпадаються в одних місцях, але знову виникають в інших.
Поверхневий натяг
Рідина здатна утворювати вільну поверхню. Така поверхня є поверхнею розділу фаз даної речовини: по один бік знаходиться рідка фаза, по інший — газоподібна (пара), і, можливо, інші гази, наприклад, повітря.
Поверхневий натяг — фізичне явище, суть якого в прагненні рідини скоротити площу своєї поверхні при незмінному об'ємі. Своєю появою сили поверхневого натягу завдячують поверхневій енергії. Поверхневий натяг може бути пояснений притяганням між молекулами рідини. Він виникає як у випадку поверхні розділу між рідиною й газом, так і у випадку поверхні розділу двох різних рідин.
Поверхнева енергія пропорційна площі поверхні поділу двох фаз S:
Eп = σ · S.
Коефіцієнт пропорційності σ, називають коефіцієнтом поверхневого натягу. Його значення залежить від природи дотичних середовищ. Цей коефіцієнт можна подати у вигляді

де F — сила поверхневого натягу;
l — довжина лінії, що обмежує поверхню поділу.
Поверхневий натяг рідини чутливий до її чистоти, складу і температури. Речовини, здатні значною мірою знизити сили поверхневого натягу, називаються поверхнево-активними речовинами (ПАР). При підвищенні температури величина сил поверхневого натягу зменшується, а в критичній точці кипіння рідини прямує до нуля.
На межі поділу вода — повітря при t=20°С коефіцієнт поверхневого натягу σ=0,073 Дж/м², а для межі поділу ртуть — повітря коефіцієнт σ=0,48 Дж/м².
Докладніше: Поверхневий натяг
Змочуваність рідин
На поверхні поділу трьох фаз, наприклад, твердої стінки, рідини і газу між поверхнею рідини і твердою стінкою утворюється так званий крайовий кут θ. Величина крайового кута залежить від природи дотичних середовищ (від поверхневих натягів на їхніх межах) і не залежить ні від форми посудини, ні від дії сили ваги. Якщо край рідини піднятий, її поверхня має увігнуту форму — крайовий кут гострий. У цьому разі рідина змочує тверду поверхню. Чим гірша змочувальна здатність рідини, тим більшим є крайовий кут. При θ>90° рідина вважається незмочувальною, при повному незмочуванні θ=180°. Краплі такої рідини немов би підгортаються, намагаючись зменшити площу контакту з твердою поверхнею.
Докладніше: Змочуваність
Капілярні явища
Від явища змочування залежить поведінка рідини в тонкій (капілярній) трубці, зануреній у неї. У разі змочування рідина в трубці піднімається над рівнем вільної поверхні, у протилежному випадку — опускається. Висоту капілярного підняття (опускання) рідини знаходять за формулою

де γ — питома вага рідини;
r — радіус трубки.
Докладніше: Капілярний ефект