 |
|
Постулати Ейнштейна
В 1905 році у роботі „До електродинаміки рухомих середовищ” А.Ейнштейн показав, що закони класичної механіки і перетворення Галілея вірні, лише коли ми маємо справу з невеликими швидкостями руху тіл і вважаємо, що швидкість розповсюдження взаємодії між тілами безконечно велика.
При швидкостях близьких до швидкості світла необхідно користуватись більш загальними законами релятивістської механіки. Основою релятивістської механіки є два постулати Ейнштейна:
1. Принцип відносності - в довільній інерціальній системі всі фізичні явища при їх тотожній постановці протікають однаково. Всі закони природи і рівняння, що їх описують, інваріантні при переході від однієї інерціальної системи відліку до іншої.
Інакше кажучи: ніякими експериментами неможна визначити, чи знаходиться дана інерціальна система в спокої, чи рухається рівномірно і прямолінійно.
2. Принцип постійності швидкості світла - швидкість світла в вакуумі є величиною постійною і однаковою в усіх інерціальних системах відліку, вона не залежить від швидкості руху джерела світла чи спостерігача.
22Теорія Бора — це історично перша теорія, що на основі „квазікласичного підходу” описала „дискретну структуру” енергетичного спектру воднеподібних атомів. Нільс Бор запропонував видозмінити класичну механіку шляхом введення сталої Планка  . Він припустив, що не всі рухи, допустимі в класичній механіці реалізуються в атомних системах, а лише деякі, можна сказати „вибрані”. Стосовно енергії атома гіпотеза Бора (або, як її називали, постулат Бора) означала, що енергія атома
. Він припустив, що не всі рухи, допустимі в класичній механіці реалізуються в атомних системах, а лише деякі, можна сказати „вибрані”. Стосовно енергії атома гіпотеза Бора (або, як її називали, постулат Бора) означала, що енергія атома  може приймати лише дискретні, квантовані значення:
може приймати лише дискретні, квантовані значення:

Постулати Бора — сформульовані датським фізиком Нільсом Бором основні положення будови атома, що враховують квантований характер енергії, випромінюваної електронами.
Формулювання
1. Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія  . У стаціонарному стані атом енергію не випромінює.
. У стаціонарному стані атом енергію не випромінює.
2. У стаціонарному стані атома електрон повинен мати дискретні (квантовані) значення моменту імпульсу. Радіуси 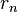 орбіт електронів задовольняють умову:
орбіт електронів задовольняють умову:
 ,
,
де  - маса електрона,
- маса електрона,  - зведена стала Планка.
- зведена стала Планка.
3. Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких  визначають за формулою:
визначають за формулою:
 ,
,
де  і
і 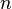 - цілі числа (номери стаціонарних станів), якщо
- цілі числа (номери стаціонарних станів), якщо  фотон з частотою
фотон з частотою 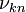 випромінюється, якщо
випромінюється, якщо  - поглинається.
- поглинається.
Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші - збудженими.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[5]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[6] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.