 |
|
Просторова структура білків
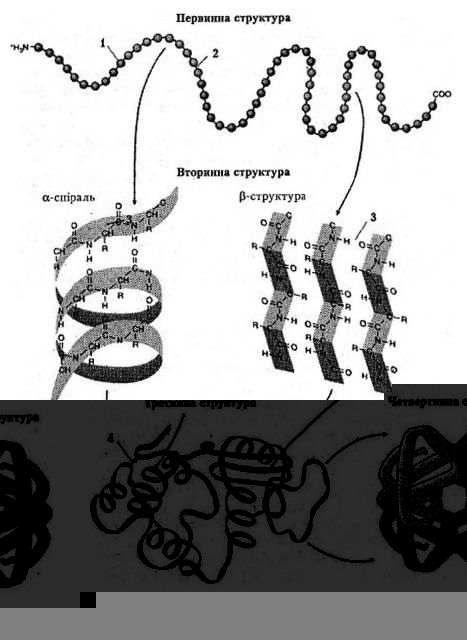
Первинна структура. Визначається порядком чергування амінокислот у пептидному ланцюзі. Амінокислоти з'єднуються міцним пептидним зв'язком.
Вторинна структура. Спірально закручений білковий ланцюжок. Витки спіралі утримуються водневими зв'язками між СО- і NH-групами, розташованими на сусідніх витках.
Третинна структура. Виникає внаслідок закручування вторинної структури в клубок (глобулу). Клубок утримується гідрофобними, йонними та водневими взаємодіями.
Четвертинна структура. Формується кількома глобулами білка. Стійку конфігурацію утворюють гідрофобні, електростатичні та водневі зв'язки.
Ферменти.
Усі ферменти є білками. Кожний фермент каталізує одну або декілька однотипних реакцій, тому зв'язування фермента із субстратом (речовиною, що піддається ферментативному перетворенню) високоспецифічне. Ділянка молекули білка, яка відповідає за зв'язування із субстратом, називається активним центром, а комплекс, що утворився при цьому,— фермент-субстратним комплексом. Суть каталізу полягає у зменшенні ферментом енергії активації (енергії, необхідної для вступу субстрату до реакції). Після завершення реакції комплекс розпадається. У процесі реакції фермент не піддається ані якісним, ані кількісним змінам.

Схема ферментативної реакції:
а) фермент (C) і субстрати (А, В); б) фермент-субстратний комплекс (ABC), в) фермент (C) і продукт реакції (AB)
Ферменти мають дуже високу активність, вони здатні послідовно каталізувати тисячі й навіть мільйони реакцій за секунду. При цьому вони функціонують у дуже вузькому інтервалі умов середовища й у разі їхньої зміни інактивуються.
Назви ферментів утворюються віл назви субстрату з додаванням закінчення -аза, наприклад пероксидаза, лактаза
Ферменти широко використовуються в народному господарстві - харчовій, текстильній промисловості, у фармакології.
Ще ширше область використання ферментів в наукових дослідженнях і в медицині.