 |
|
Кристаллографические обозначения
Кристаллографы применяют несколько способов для описания свойств симметрии различных типов кристаллов. Методы, разработанные для этой цели, используются в кристаллографии для систематизации сведений о многих элементах и соединениях. Большая часть этих методов создана еще до появления современной техники изучения атомов, но, тем не менее, они не утратили своей практической ценности. Краткое ознакомление с формальным языком кристаллографии поможет пониманию дальнейшего материала.
Одна из наиболее важных задач кристаллографии состоит в том, чтобы позволить описать направления в пространстве.
Так, в некоторых случаях возникает необходимость в определении направления отдельных атомных рядов. Простой метод решения этих задач основан на применении векторных обозначений. Поскольку мы рассматриваем почти всегда только кубические решетки, мы опишем этот метод применительно к кубу. Пусть проекции вектора на оси х, у и z элементарного куба представляют собой некоторые числа  ,
,  и
и 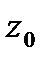 . Эти проекции удобно измерять в единицах длины ребра куба а. Тогда найдется такое число (например, г), что отношения
. Эти проекции удобно измерять в единицах длины ребра куба а. Тогда найдется такое число (например, г), что отношения  ,
,  и
и  составят ряд наименьших целых чисел, пропорциональных этим проекциям. Эти величины называются индексами направлений. Их можно обозначить как u, v и w соответственно. Рассмотрим в качестве примера вектор, проекции которого па оси координат равны
составят ряд наименьших целых чисел, пропорциональных этим проекциям. Эти величины называются индексами направлений. Их можно обозначить как u, v и w соответственно. Рассмотрим в качестве примера вектор, проекции которого па оси координат равны  ,
,  ,
,  . Разделим эти числа на 0,5a (т. е. r=0,5 а). Тогда получим три числа: 6, 8 и 5. Они относятся друг к другу так же, как исходные размеры проекций, и в то же время представляют собой последовательность из наименьших целых чисел, обладающих этим свойством. Поэтому полученные числа — это индексы исходного вектора.
. Разделим эти числа на 0,5a (т. е. r=0,5 а). Тогда получим три числа: 6, 8 и 5. Они относятся друг к другу так же, как исходные размеры проекций, и в то же время представляют собой последовательность из наименьших целых чисел, обладающих этим свойством. Поэтому полученные числа — это индексы исходного вектора.
Для удобства индексы направлений заключаются в квадратные скобки [u v w]. Отрицательные значения проекций на любую координатную ось имеют отрицательный индекс и отмечаются чертой над соответствующим индексом. Направления, эквивалентные по характеру симметрии относительно всех трех координатных осей, образуют группу. Индексы этих направлений записывают вместе и заключают в угловые скобки: <u v w>.
Примеры. Ось +x имеет индексы [100], ось -х — индексы [  ]. Индексы оси +у —[010], -у — [
]. Индексы оси +у —[010], -у — [  ]. Диагональ грани ху обозначается индексами [110], а грани xz— [101]. Диагональ куба в положительном квадранте имеет индексы [111], а в противоположном направлении [
]. Диагональ грани ху обозначается индексами [110], а грани xz— [101]. Диагональ куба в положительном квадранте имеет индексы [111], а в противоположном направлении [  ]. Восемь диагоналей куба [111], [
]. Восемь диагоналей куба [111], [  ], [
], [  ], [
], [  ], [
], [  ], [
], [ 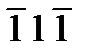 ], [
], [  ] и [
] и [  ] обозначаются как группа <111>; все они получаются перестановкой индексов ±1.
] обозначаются как группа <111>; все они получаются перестановкой индексов ±1.
Эта система обозначений очень проста. Она обладает всеми преимуществами векторной записи, кроме одного: в ней не фигурирует величина самого вектора, которая сокращается во время приведения проекций к целым числам. Эта потеря не столь уж серьезна, так как в случае необходимости можно вычислить расстояние в любом направлении. Достоинства системы индексов с избытком компенсируют этот маленький недостаток.
Набор параллельных атомных плоскостей можно охарактеризовать с помощью трех чисел — индексов Миллера для плоскости. Эти числа связаны с длиной отрезков, отсекаемых плоскостью на осях координат. Пусть одна из плоскостей данной серии проходит через начало координат. Допустим, что соседняя плоскость отсекает на осях отрезки  ,
,  и
и  , измеренные в единицах длины ребра куба (рис.12). Тогда существует такое число s, которое при умножении на обратные значения этих отрезков дает ряд наименьших целых чисел, относящихся друг к другу как
, измеренные в единицах длины ребра куба (рис.12). Тогда существует такое число s, которое при умножении на обратные значения этих отрезков дает ряд наименьших целых чисел, относящихся друг к другу как 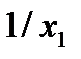 ,
,  и
и  . Введем обозначения:
. Введем обозначения:  ,
, 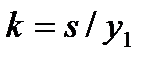 и
и  . Числа h, k, l называются индексами Миллера
. Числа h, k, l называются индексами Миллера
| Рис. 12. Пересечения произвольно выбранной плоскости с осями прямоугольной системы координат. |

для плоскости; они записываются в круглых скобках: (hkl). Рассмотрим в качестве примера плоскость, которая пересекается с осями координат в точках  ,
,  и
и 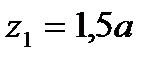 . Обратные значения этих дробей можно привести к целым числам, если выбрать s=7,5a. Тогда h=7,5a/0,5a=15, k=7,5a/1,25a=6, l=7,5a/1,5a=5. Эта плоскость обозначается (15, 6, 5), т. е. индекс плоскости велик по сравнению с индексами граней куба.
. Обратные значения этих дробей можно привести к целым числам, если выбрать s=7,5a. Тогда h=7,5a/0,5a=15, k=7,5a/1,25a=6, l=7,5a/1,5a=5. Эта плоскость обозначается (15, 6, 5), т. е. индекс плоскости велик по сравнению с индексами граней куба.
В отношении индексов плоскостей действуют те же общие правила, что и для индексов направлений. Отрицательные индексы обозначают плоскости, пересекающиеся с отрицательными направлениями координат. Плоскость с отрицательным х записывается (  ). У плоскостей кристалла, эквивалентных по характеру симметрии, индексы заключаются в фигурные скобки: {hkl}. Например, плоскости {111} охватывают группу: (
). У плоскостей кристалла, эквивалентных по характеру симметрии, индексы заключаются в фигурные скобки: {hkl}. Например, плоскости {111} охватывают группу: (  ), (
), (  ), (
), (  ), (
), (  ), (
), ( 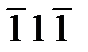 ), (
), (  ), (
), (  ).
).
Отметим несколько характерных особенностей этой схемы применительно к кубическим системам. 1) У параллельных одинаково ориентированных плоскостей индексы одинаковы (hkl). Аналогичное правило справедливо и в отношении индексов направлений: у параллельных атомных рядов индексы одинаковы [uvw]. 2) Плоскость, параллельная одной из координатных осей, имеет индекс 0 для этого направления. 3) Плоскость, проходящая через начало координат, записывается с помощью индексов параллельной плоскости, которая отсекает на осях отрезки конечной длины.
Примеры. Грань куба, перпендикулярная оси х, записывается индексами (100). Плоскости этого типа изображены на рис. 13- а. Плоскости, перпендикулярные оси у, имеют индексы (010) (рис. 13- б). Плоскости, отсекающие одинаковые отрезки на всех трех осях,— это плоскости (111) (рис. 13- в). Индексы (  ) определяют плоскости, которые параллельны оси z и отсекают равные отрезки на осях х и у (рис. 13- г). Некоторые плоскости могут пересекаться с одной или двумя отрицательными полуосями. Пример — семейство параллельных плоскостей (110) (рис. 13- д). Наконец, на рис. 13- е показаны плоскости (112).
) определяют плоскости, которые параллельны оси z и отсекают равные отрезки на осях х и у (рис. 13- г). Некоторые плоскости могут пересекаться с одной или двумя отрицательными полуосями. Пример — семейство параллельных плоскостей (110) (рис. 13- д). Наконец, на рис. 13- е показаны плоскости (112).
Обозначение плоскостей индексами Миллера особенно удобно для кубических систем. Перечислим основные преимущества.
1) Легко рассчитать угол  между двумя кристаллографическими направлениями
между двумя кристаллографическими направлениями  и
и  . Для этой цели служит уравнение
. Для этой цели служит уравнение
 (1)
(1)
2) Нормаль к плоскости с индексами (hkl) лежит в направлении [hkl]. Это соответствие чрезвычайно облегчает вычисление углов между плоскостями, так как позволяет применять непосредственно для этой цели уравнение (2.1).
3) Расстояние d между соседними плоскостями с индексами (hkl) можно вычислить в единицах длины ребра куба с помощью уравнения
 (2)
(2)
Расстояния между плоскостями с большими индексами малы по сравнению с расстояниями между плоскостями, имеющими малые индексы. У плоскостей с малыми индексами более высокая плотность расположения атомов (количество атомов на единицу площади), чем у плоскостей с большими индексами. При определении физических и химических свойств твердого тела в большинстве случаев наиболее важны плоскости с небольшими индексами. Плоскости с индексами более 3 рассматриваются очень редко. С физической точки зрения представляют интерес примерно лишь 15 групп плоскостей.

Рис. 13. Примеры важных кристаллографических плоскостей в кубической структуре. а – плоскости (100); б – плоскости (010); в – плоскости (111); г – плоскости (110); д – плоскости (  ); е – плоскости (112).
); е – плоскости (112).
Таблица 1
Некоторые сведения об элементарных кубических структурах
| Простая кубическая | о.ц.к. | г. ц. к. | Решетка алмаза | |
| Координационное число | ||||
| Атомный радиус (а — ребро куба) | а/2 | a 
| а 
| a 
|
| Количество атомов в элементарном кубе | ||||
| Плотность упаковки | 
| 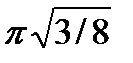
| 
| 
|
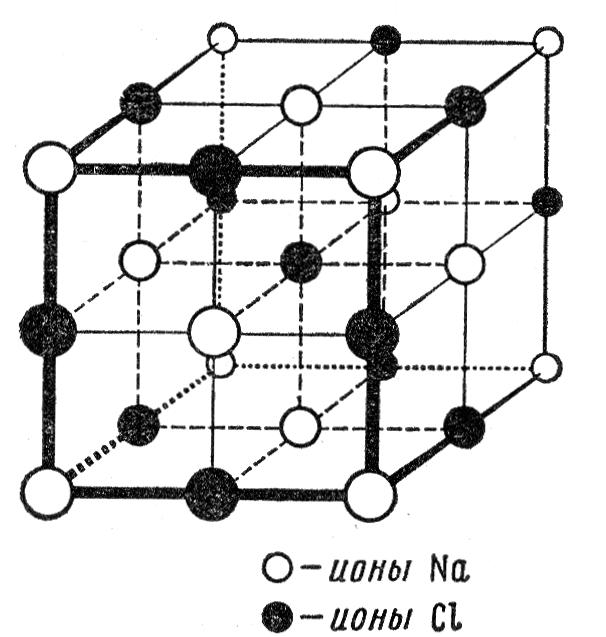 Рис. 9. Структура кристалла NaCl.
Рис. 9. Структура кристалла NaCl.
Таблица.2
Атомные радиусы некоторых элементов
| Элемент | Атомный радиус, Å | Элемент | Атомный радиус, Å | Элемент | Атомный радиус, Å |
| А1 | 1,43 | Hf | 1,58 | Rh | 1,34 |
| Ag | 1,44 | Ir | 1,36 | Ru | 1,32 |
| Au | 1,44 | К | 2,31 | Si | 1,18 |
| Be | 1,11 | Li | 1,52 | Sn (серое) | 1,41 |
| С | 0,72 | Mg | 1,60 | Та | 1,43 |
| Со | 1,43 | Mo | 1,36 | Ti | 1,45 |
| Cd | 1,49 | Na | 1,86 | Th | 1,80 |
| Сг | 1,25 | Ni | 1,25 | Tl | 1,70 |
| Cs | 2,63 | Os | 1,34 | V | 1,32 |
| Си | 1,28 | Pb | 1,75 | W | 1,37 |
| Fe | 1,24 | Pd | 1,38 | Zn | 1,33 |
| Ge | 1,23 | Pt | 1,38 | Zr | 1,59 |
Если две вспомогательные гранецентрированные кубические решетки заняты атомами разных элементов, то при этом возникает новая структура, которая называется структурой цинковой обманки (рис. 8- в). Важнейшими соединениями с такой структурой являются полупроводники InSb, GaAs, ZnS (который и дал название этому типу структуры), CuCl и многие другие.
Другой тип комбинированной структуры имеет каменная соль NaCl. Элементарная ячейка этой структуры показана на рис..9. Она состоит из двух гранецентрированных кубических подрешеток. Первая подрешетка содержит ионы Na и один из ее узлов расположен в начале координат (в точке 0, 0, 0). Другая подрешетка состоит из ионов С1, которые находятся на серединах ребер первого куба, например в точке ( а/2, 0, 0). Если не делать различия между ионами Na и Сl, то такая решетка будет простой кубической.
Еще одним видом комбинированной кристаллической структуры обладает соединение CsCl. Его решетка состоит из двух вставленных друг в друга простых кубических решеток, причем вершина одной из них расположена в центре другого куба. Одна решетка занята только ионами Cs, а другая — только ионами Сl. Возникающая при этом структура (рис..10) называется структурой типа хлористого цезия.
Эти примеры охватывают только небольшое количество существующих структур. Среди других структур многие также являются простыми, но некоторые чрезвычайно сложны. Кроме нескольких исключений, каждое твердое тело, рассматриваемое в этой книге, имеет одну из описанных выше структур. Поэтому мы не будем рассматривать иные типы кристаллов.
 Рис. 10. Структура кристалла CsCl.
Рис. 10. Структура кристалла CsCl.