 |
|
Основні класи неорганічних сполук. Солі. Назви, класифікація, добування, властивості.


Солі класифікують на середні, кислі і основні.
Середні солі - не вміщують ні катіонів Гідрогену, ні гідроксид-іонів.
Наприклад: Na3PO4 (фосфат Натрію), K2CO3 (карбонат Калію).
Кислі солі - до складу кислотних залишків входять катіони Гідрогену.
Наприклад: NaH2PO4 (дигідрофосфат Натрію), KНCO3 (гідрокарбонат Калію).
Основні солі - до складу основних залишків входять гідроксид-іони.
Наприклад: (CuOH)2CO3 (гідроксокарбонат Міді), MgOHCl (гідроксохлорид Магнію).
Добування солей
Найважливіші способи добування солей:
1. Реакція нейтралізації: КОН + HNО3 = KNО3 + Н2О
2. Взаємодія кислот з основними оксидами: CuO + H2SО4 = CuSO4 + Н2О
3. Взаємодія кислот із солями: ВаСl2 + H2S04 = BaS04u95; + 2НСl
4. Взаємодія кислот з металами: Mg + 2HCl = MgCl2 + H2u93;
5. Взаємодія двох різних солей: AgNО3 + КСl = AgClu95; + KNО3
6. Взаємодія солей з металами: Fe + CuSO4 = FeSО4 + Cu
7. Взаємодія солей з лугами: ЗКОН + FeCl3 = Fe(OH)3u95; + ЗКСl
8. Взаємодія лугів з кислотними оксидами: Са(ОН)2 + СО2 = СаСО3 + Н2О
9. Взаємодія основних оксидів з кислотними: СаО + SiО2 = CaSiО3
10. Взаємодія металів із неметалами: Fe + S = FeS
Є й інші способи добування солей. Отже, солі утворюються внаслідок хімічної взаємодії неорганічних сполук різних класів між собою та з простими речовинами.
35. Гідроген, будова атома. Ізотопи Гідрогену, поширення в природі. Молекула водню.Способи добування водню (в лабораторії та промисловості). Фізичні та хімічні властивості водню. Застосування.

Гідроген
Місце гідрогену в періодичній системі. Гідроген займає перше місце в періодичній системі (Z = 1). Він має найпростішу будову атома: ядро атома оточене електронною хмарою. Електронна конфігурація ls1.
За одних умов гідроген виявляє металічні властивості (віддає електрон), за інших — неметалічні (приєднує електрон). Однак за властивостями він більше подібний до галогенів, ніж до лужних металів. Тому гідроген розміщують у VII групі періодичної системи елементів Д.І. Менделєєва, а в І групі символ гідрогену беруть у дужки (див. § 2.9).
Поширення в природі. Гідроген широко розповсюджений у природі — міститься у воді, в усіх органічних сполуках, у вільному стані — в деяких природних газах. Вміст його у земній корі досягає 0,15 % її маси (із урахуванням гідросфери — 1 %). Гідроген становить половину маси Сонця.
У природі гідроген трапляється у вигляді двох ізотопів — протію (99,98 %) і дейтерію (0,02 %). Тому у звичайній воді містяться невеликі кількості важкої води.
Добування. В лабораторних умовах гідроген добувають такими способами.
1. Взаємодією металу (цинку) з розчинами хлоридної або сульфатної кислоти (реакція проводиться в апараті Кіппа):
Zn + 2Н+ = Zn2+ + Н2 ↑ .
2. Електролізом води. Для збільшення електричної
провідності води до неї додають електроліт, наприклад NaOH, H2SO4 або NaSO4. На катоді утворюється 2 об’єми гідрогену, на аноді — 1 об’єм кисню. Схема електролізу розглянута раніше (див. § 7.7).
У промисловості гідроген добувають також кількома способами.
1. Електролізом водних розчинів КСl або NaCl як побічний продукт (див. § 13.3).
2. Конверсійним способом (конверсія — перетворення). Спочатку добувають водяний газ, пропускаючи водяну пару через розжарений кокс при 1 000°С:
С + Н2О = СО + Н2.
Потім оксид карбону(ІІ) окиснюють до оксиду карбону(ІV), пропускаючи суміш водяного газу з надлишком водяної пари над нагрітим до 400—450°С каталізатором Fе2О3:
СО + (Н2) + Н2О = СО2 + Н2 + (Н2).
Оксид карбону(ІУ), що утворюється, поглинається водою. Цим способом добувають більше ніж 50 % промислового водню.
3. Конверсією метану з водяною парою:
СН4 + 2Н2О = СО2 + 4Н2.
Реакція відбувається за наявності нікелевого каталізатора при 1 300°С . Цей метод дає змогу використовувати природні гази і добувати найдешевший водень.
4. Нагріванням метану до 350°С за наявності залізного або нікелевого каталізатора:
СН4 = С + 2Н2.
5. Глибоким охолодженням (до — 196°С) коксового газу. Під час такого охолодження всі газуваті речовини, крім водню, конденсуються.
Фізичні властивості. Водень — газ без кольору, смаку і запаху. Це найлегший газ (у 1 л води при 20°С розчиняється 18 мл водню). При температурі —252,8°С і атмосферному тиску переходить у рідину. Рідкий водень безбарвний.
Крім гідрогену з масовим числом 1 існують ізотопи з масовими числами 2 і 3 — дейтерій D і тритій Т.
Хімічні властивості. У сполуках гідроген завжди одновалентний. Для нього характерний ступінь окиснення +1, але в гідридах металів (див. нижче) він дорівнює —1. Молекула гідрогену складається з двох атомів. Виникнення зв’язку між ними пояснюється утворенням усуспільненої пари електронів (або спільної електронної хмари):
Н : Н, або Н2.
Завдяки цьому усуспільненню електронів молекула Н2 енергетично більш стійка, ніж його окремі атоми. Щоб розщепити в 1 моль гідрогену молекули на атоми, слід витратити енергію 436 кДж:
Н2 = 2Н, ∆ Н° = 436 кДж/моль.
Цим пояснюється порівняно невелика активність молекулярного гідрогену за звичайної температури.
Із багатьма неметалами гідроген утворює газуваті сполуки типу RH4, RH3, RH2, RH (див. періодичну систему).
Водень горить у кисні з виділенням великої кількості теплоти. Температура воднево-кисневого полум’я досягає 3 000°С. Суміш двох об’ємів гідрогену й одного об’єму кисню називається гримучим газом. При підпалюванні така суміш дає сильний вибух. Як під час горіння водню у кисні, так і під час вибуху гримучої суміші утворюється вода:
2Н2 + О2 = 2Н2О.
Під час роботи з воднем необхідно бути дуже обережним: завчасно перевірити герметичність апаратури, а також чистоту водню перед його підпалюванням.
При високій температурі водень сполучається з лужними і лужноземельними металами, утворюючи білі кристалічні речовини — гідриди металів (LiH, NaH, КН, СаН2 та інші). У цих сполуках метал виявляє позитивний ступінь окиснення, гідроген — негативний.
Гідриди металів легко розкладаються водою з утворенням відповідного лугу і водню:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2↑.
Підвищену реакційну здатність виявляє атомарний водень: при кімнатній температурі він відновлює оксиди металів, взаємодіє з киснем, сіркою і фосфором. Пальник, що працює
на атомарному водні, створює температуру понад 4 000°С. Висока температура зумовлена перебігом екзотермічної реакції:
Н + Н = Н2, ∆Н° — —436 кДж/моль.
Під час нагрівання водень відновлює багато металів з їх оксидів. Наприклад:
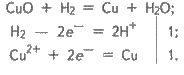
У цій реакції гідроген віддає один електрон (молекула гідрогену — два електрони), він — відновник:
Н — е- = Н+.
Однак атом гідрогену може приєднувати один електрон (молекула — два електрони):
Н + е- = Н-
Це відбувається, наприклад, під час утворення гідридів металів. У цьому випадку гідроген — окисник.
Застосування. Застосування водню базується на його фізичних і хімічних властивостях. Як легкий газ він використовується для наповнення аеростатів і дирижаблів (у суміші з гелієм).
Застосовують водень для одержання високих температур: киснево-водневим полум’ям ріжуть і зварюють метали. Його використовують для добування металів (молібдену, вольфраму тощо) з їх оксидів, у хімічній промисловості — для добування аміаку з азоту повітря і штучного рідкого палива з вугілля; у харчовій промисловості — для гідрогенізації жирів (див. § 17.14). Ізотопи гідрогену — дейтерій і тритій — широко застосовують в атомній енергетиці (термоядерне паливо).