 |
|
Вплив замісників у молекулах спиртів на їх властивості
Опорні конспекти з хімії
з теми № 2:
Оксигеновмісні органічні речовини
Насичені одноатомні спирти
Уч__________ 11 - М класу
Хімічні елементи Оксиген, Нітроген, Сульфур входять до складу органічних сполук у вигляді функціональних груп. В таких речовинах вуглецевий радикал зв’язаний з функціональною групою.
Функціональна група –це атом або група атомів, які мають постійний склад, визначають властивості органічних сполук та їх приналежність до гомологічного ряду.
ГІДРОКСИСПОЛУКИ
¾ OHгідроксогрупа {гідроксильна група} - функціональна група двох споріднених гомологічних рядів:
¶ 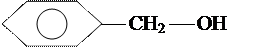 спиртів: R ¾ OH
спиртів: R ¾ OH
СН3 ¾ СН2 ¾ ОН
¶  фенолів: Ar ¾ OH
фенолів: Ar ¾ OH
Спирти R ¾ OH
Спирти – похідні вуглеводнів, в молекулах яких один або декілька атомів Гідрогену заміщено на гідроксогрупи
Ú Класифікація спиртів
Кількість гідроксогруп
¶ одноатомні
СН3 ¾ СН2 ¾ СН2 ¾ ОН
¶ двохатомні
НО ¾ СН2 ¾ СН2 ¾ СН2 ¾ ОН
¶
|
‚ Характер вуглецевого радикалу
w ациклічні, насичені
СН3 ¾ СН2 ¾ СН2 ¾ СН2 ¾ ОН
w ациклічні, ненасичені
СН2 ═ СН ¾ СН2 ¾ СН2 ¾ ОН
w ароматичні
Ar ¾ (СН2)n ¾ ОН
ƒ Місце гідроксогрупи у вуглецевому радикалі
w первинні
СН3 ¾ СН2 ¾ СН2 ¾ СН2 ¾ ОН
w
|
w
|
ÚНоменклатура спиртів
(IUPAC) суфікс – ол
~ Головний ланцюг має містити найбільшу кількість атомів Карбону, а також включати атом Карбону, біля якого розміщена гідроксогрупа.
~ При нумерації головного ланцюга дотримуються принципу “старшинства”:
функціональна група ® кратний зв’язок ® радикали
 |
Замісникова
Назва спирту утворюється - назва R + иловий спирт
СН3 ¾ СН2 ¾ СН2 ¾ СН2 ¾ ОН
СН3 ¾ СН2 ¾ ОН
Насичені одноатомні спирти. Алканоли
1Нагадай! Загальну формулу насичених вуглеводнів – алканів!
СnH2n+2
Так як насичені одноатомні спирти розглядають як похідні насичених вуглеводнів у яких один атом Гідрогену заміщено на гідроксогрупу Þ
СnH2n+1OHабо СnH2n+2O, n ³ 1
n = 1: СН3ОН – метанол, метиловий спирт, {деревний спирт}
n = 2: С2Н5ОН – етанол, етиловий спирт, {винний спирт}
ÚІзомерія спиртів
w ізомерія вуглецевого скелету
w ізомерія положення функціональної групи
w міжкласова ізомерія (насичені одноатомні спирти ізомерні етерам R ¾ O ¾ R)
СН4О – ізомерів не має
СН3ОН – метанол
С2Н6О – міжкласові ізомери
СН3 ¾ СН2 ¾ ОН етанол
СН3 ¾ О ¾ СН3
метоксиметан
Кількість ізомерів, які можуть утворювати насичені одноатомні спирти (без врахування між класової ізомерії):
° С3Н8О - 2
° С4Н10О - 4
° С5Н12О – 8
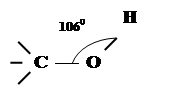
ÚБудова спиртів
Будова функціональної групи, а також взаємний вплив вуглецевого радикалу і атомів функціональної групи визначають будову органічної речовини.

|

 Так як атом Оксигену більш електронегативний, ніж атоми Карбону і Гідрогену, електронна густина зв’язків С ¾ О та О ¾ Н зміщена до атому Оксигену.
Так як атом Оксигену більш електронегативний, ніж атоми Карбону і Гідрогену, електронна густина зв’язків С ¾ О та О ¾ Н зміщена до атому Оксигену.
m Зверни увагу! Полярність зв’язку О ¾ Н більша полярності зв’язку С ¾ О.
ÚФізичні властивості
за звичайних умов -безбарвні
С1 – С11 – рідини
С12 – тверді речовини
¶ tкип (спиртів):
î більше, ніж tкип (вуглеводнів з відповідною молекулярною масою)
î tкип (спиртів) більше, ніж tкип (ізомерних етерів)
î tкип (спиртів з розгалуженим скелетом) менше, ніж tкип (cпиртів з лінійною будовою).
¶ спирти добре розчиняються у воді, при = кількості атомів Карбону в молекулі, розчинність спиртів ? , а в органічних розчинниках =
î С1 – С3 – необмежено розчиняються у воді
î С4 – С5 – розчинність обмежена
î вищі спирти – нерозчинні у воді
¶ запах спиртів
î нижчі спирти мають алкогольний запах
î третинні – сивушний
î вищі – без запаху
¶ фізіологічна дія– отрута, наркотична дія
î СН3ОН– дуже сильна отрута {10 мл – сліпота, 30 мл – летальний кінець}
Аномальні фізичні властивості спиртів зумовлені:
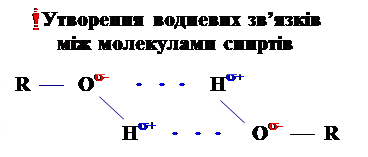 На фізичні властивості спиртів впливає наявність в їх молекулах полярних гідроксогруп.
На фізичні властивості спиртів впливає наявність в їх молекулах полярних гідроксогруп.
За рахунок водневих зв’язків між рухливим атомом Гідрогену однієї гідроксогрупи та вільних електронних пар атому Оксигену сусідньої гідроксогрупи, молекули спиртів об’єднуються в асоціати Þ
___________________________________________________________________
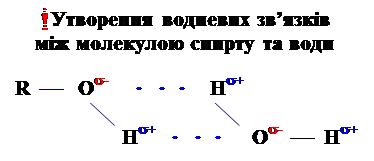 Þ ______________________________________________________________
Þ ______________________________________________________________
Розчинність спиртів у полярних і неполярних розчинниках залежить від того, яка частина загальної маси молекули спирту припадає на гідроксогрупу.
Нижчі спирти необмежено розчинні у воді через утворення водневих зв’язків між молекулами спирту та води.
Із підвищенням молекулярної маси зростає вуглеводнева – неполярна частина молекули і зменшується відносний вміст полярної частини молекули - гідроксогрупи. Þ при = кількості атомів Карбону в молекулах спиртів, їх розчинність у воді ?, а в органічних розчинниках =.
ÚХімічні властивості спиртів
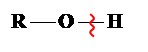 Полярність зв’язку О ¾ Н зумовлює кислотні властивості спиртів.
Полярність зв’язку О ¾ Н зумовлює кислотні властивості спиртів.
m Кислотні властивості спиртів виражені так слабко, що спирти у водних розчинах не змінюють забарвлення індикаторів Þ водні розчини спиртів – нейтральні.
Вплив замісників у молекулах спиртів на їх властивості
Замісники (+І)
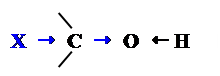 Þ зменшується полярність зв’язку О ¾ Н Þ спадають кислотні властивості спиртів
Þ зменшується полярність зв’язку О ¾ Н Þ спадають кислотні властивості спиртів
Всі вуглецеві радикали володіють позитивним індукційним ефектом R (+I)Þ в рядах:
|
‚ Замісники (-І)
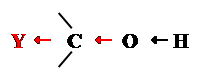 Þ зростає полярність зв’язку О ¾ Н Þ зростають кислотні властивості спиртів
Þ зростає полярність зв’язку О ¾ Н Þ зростають кислотні властивості спиртів
Hal (-I)володіють негативним індукційним ефектом Þ в рядах:

 Кислотні властивості спиртів – підтверджуються їх взаємодією з лужними, лужноземельними металами, Al.
Кислотні властивості спиртів – підтверджуються їх взаємодією з лужними, лужноземельними металами, Al.
CH3 – OH + Al ®
CH3 – CH2 – ONa – натрій етилат
(CH3 – O)3Al - алюміній метилат
 Водні розчини алкоголятів – легко гідролізують, так як навіть вода є сильнішою кислотою, ніж спирти (крім метанолу)
Водні розчини алкоголятів – легко гідролізують, так як навіть вода є сильнішою кислотою, ніж спирти (крім метанолу)
CH3 – CH2 – ONa + HOH D CH3 – CH2 – OH + NaOH
‚ Реакції заміщення гідроксогупи галогеном - SN
CH3 – CH2 – OH + HCl® CH3 – CH2 – Cl + H2O
в пробірці:
CH3 – CH2 – OH + KCl + H2SO4 ® CH3 – CH2 – Cl + H2O + KHSO4
ƒ Реакції дегідратації
~ реакції внутрішньомолекулярної дегідратації
|
m Зверни увагу! Молекула води найлегше відщеплюється від молекул третинного спирту.
m Зверни увагу! Спирт, який не може вступати в реакцію внутрішньо молекулярної дегідратації – це ___________________________
~ реакції міжмолекулярної дегідратації– реакції утворення етерів
[t0 < 1700, kat – H2SO4]
 | ||
|
|
Ааа
Ааа
Ааа
m Для добування одного несиметричного етеру проводять синтез Вільямсона –взаємодія галогенпохідних алканів з алкоголятами.
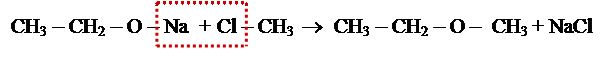 [t0]
[t0]
„ Реакції естерифікації(англ – ester – складний ефір) – реакції взаємодії спиртів з органічними або мінеральними кислотами, що призводять до утворення естерів.
 mЗверни увагу!:
mЗверни увагу!:
~ взаємодія з органічними кислотами
[t0, kat – H2SO4]
 |
_______________________________________

_______________________________________
_______________________________________
~ взаємодія з мінеральними кислотами
[t0, kat – H2SO4]
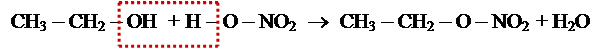 |
_______________________________________
_______________________________________
|
_______________________________________
_______________________________________
… Реакції окиснення
~ реакції повного окиснення – горіння
Метанол та етанол горять синюватим полум’ям з виділенням великої кількості тепла.
СН4О + О2 ®
С2Н6О + О2 ®
~ реакції часткового окиснення
Продукти часткового окиснення спиртів залежать від:
¶ положення гідроксогрупи у вуглецевому радикалі (первинні, вторинні, третинні)
¶ сили окисника.
m первинний спирти ® альдегід [[О] – CuO, t0]
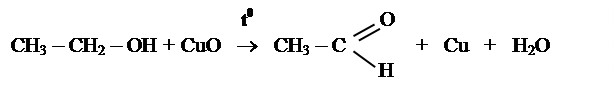 |
m первинний спирт ® карбонова кислота
[[О] – KMnO4, K2Cr2O7, CrO3 (H+) ]
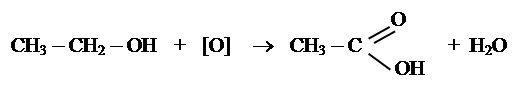 |
CH3 – CH2 – ОН + K2Cr2O7 + H2SO4 ®
m*** вторинний спирт ® кетон
 |
m третинні спирти ≠
Окиснення третинних спиртів можливе при дії дуже сильних окисників і призведе до руйнування вуглецевого скелету з утворенням різних карбонових кислот та кетонів.
ÚЯкісна реакція на насичені одноатомні спирти
дія хромової суміші (K2Cr2O7 + H2SO4)на первинні та вторинні спирти.
Оранжево-червоний розчин хромової суміші при додаванні в розчин первинного або вторинного спирту набуває зеленого забарвлення.
$дивись р.р.взаємодії етанолу та K2Cr2O7 в присутності H2SO4
ÚСпособи добування спиртів
Лужний гідроліз моногалогенпохідних вуглеводнів
|
1Нагадай! Взаємодія моногалогенпохідних вуглеводнів із спиртовим розчином лугу при t0 призводить до утворення __________________________
|
‚ Гідратація алкенів
|
ƒ Гідрування альдегідів та кетонів
альдегід ® первиннийспирт[ t0, kat - Ni]
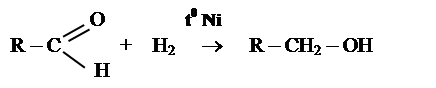 |
кетон ® вториннийспирт [ t0, kat - Ni]
|
„ Гідроліз естерів
 |
… Синтол-процес - синтез спиртів із синтез-газу
[kat – Ме родини Fe, P – 1800-2500 кПа]
3СО + 6Н2 ® CH3 – CH2 – CH2 – OH + 2Н2О
ÚОкремі представники спиртів