 |
|
Свинца и бария хромат-ионом
Полярография
Полярографический метод относится к группе методов, объединенных общим названием вольтамперометрия.
Вольтамперометрия – это совокупность электрохимических методов анализа, основанных на изучении зависимости силы тока в электролитической ячейке от потенциала погруженного в анализируемый раствор индикаторного микроэлектрода.
Вольтамперометрия включает классическую полярографию, инверсионную вольтамперометрию, осциллографическую, переменно-токовую и импульсную вольтамперометрию, а также волтамперометрическое титрование и некоторые другие методы. Во всех этих методах исследуют зависимость вольтамперометрических характеристик от электрохимического процесса окисления или восстановления веществ, находящихся в растворе. Электрохимический процесс происходит на погруженном в раствор электроде под влиянием протекающего через него электрического тока.
Полярографический метод был предложен в 1922 году чешским ученым Я.Гейровским и основан на изучении явлений, происходящих на ртутном капающем электроде под действием постоянного тока. Название метода связано с процессами поляризации, возникающими при протекании электрического тока через растворы электролитов.
Для осуществления полярографического процесса (электрохимического процесса) используются два электрода: электрод индикаторный и электрод сравнения, или, как чаще называют в электрохимии, катод и анод. На катоде в полярографии происходит процесс восстановления, на аноде – окисления. Наибольшее распространение в полярографии получил ртутный капающий электрод, выступающий в роли катода. Анодом служит донная ртуть, т.е. ртуть – катод, и ртуть – анод.
Электрод, на котором происходит аналитическая электрохимическая реакция, должен быть поляризован. Чтобы добиться поляризации нужно использовать индикаторный электрод с малой поверхностью относительно электрода сравнения. Наиболее эффективным оказался капающий ртутный электрод, состоящий из толстостенного капилляра, через который капает ртуть из расположенного над капиллярной трубкой резервуара.
При использовании капающего ртутного электрода наблюдается постоянное значение силы предельного диффузионного тока; это указывает на то, что рост капель компенсирует влияние уширения диффузионного слоя. Кроме того, процесс переноса электронов на каждой последующей капле начинается в условиях, когда ртуть имеет чистую поверхность.
Многие металлы образуют амальгамы, поэтому в процессе измерения не накапливаются продукты, которые могли бы сказываться на природе ртутной капли в процессе ее жизни.
Наконец, высокое перенапряжение водорода на ртути позволяет работать с кислыми растворами в области относительно больших отрицательных значений потенциалов.
Принципиальная схема полярографической установки изображена на рис. 32.

Рис. 32. Принципиальная схема полярографической установки:
1 – катод, 2 – полярографическая ячейка , 3 – донная ртуть (анод),
4 – толстостенный капилляр, 5 – сосуд со ртутью, 6 – реостат,
7 – чувствительный гальванометр, 8 - вольтметр
Анализируемый раствор 1 находится в электролизере 2, на дне которого имеется слой ртути 3, являющийся анодом. Катодом служит ртутный капельный электрод 4 соединенный с резервуаром ртути 5. Напряжение, подаваемое на электроды, можно плавно менять с помощью реохорда или делителя напряжения 6, контролируя его величину вольтметром 8 и измерять при этом гальванометром 7 силу тока, проходящего через раствор.
Напряжение Е, приложенное к какой-нибудь цепи, распределяется в ней в соответствии с величинами сопротивлений отдельных ее участков и равно сумме падений напряжения на этих участках.
Применительно к электролитической ячейке это означает, что в каждый данный момент значение налагаемой на электроды поляризующей э.д.с. равно сумме скачков потенциала на аноде Еа и катоде Ек и падению напряжения в расторе iR, где R – сопротивление раствора, i - сила тока:
Е = Еа – Ек + iR
При неполяризующемся аноде его неизменный потенциал может служить началом отсчета для величин потенциала катода. Другими словами, величина Еа в этом случае принимается за нуль.
Тогда получим:
Е = - Ек + iR
При малой силе тока, протекающей через полярографическую ячейку (порядка 10-6 А) и сопротивлении раствора электролита не превышающем 1000 Ом, падение напряжения в растворе составит величину порядка 10-3 В. Такой величиной можно, как правило, пренебречь и считать, что практически
Е = - Ек
Следовательно, если обеспечить достаточно высокую электропроводность раствора, то можно считать, что величина поляризующей э.д.с. с достаточным приближением равна потенциалу поляризующегося электрода.
При увеличении поляризующей э.д.с. потенциал ртутного капельного электрода в соответствии с равенством Е = - Ек будет возрастать по абсолютной величине, приобретая все более отрицательное значение. Одновременно, определенным образом будет изменяться и сила тока.
Характер изменения этих величин в общем будет соответствовать форме поляризационной кривой – полярографической волны (рис. 33).
 |
Рис.33. Полярографическая волна
В начале процесса, при небольших значения наложенной э.д.с. сила тока, протекающего через раствор будет постоянной и лишь очень медленно возрастает за счет так называемого остаточного тока ir который является суммой двух слагаемых:
ir = ic + if
где ic – конденсаторный ток, или ток заряжения
if – фарадеев ток
Конденсаторный ток обусловлен тем, что при наложении потенциала вокруг ртутной капли образуется двойной электрический слой, а капля все время обновляется и поэтому затрачивается какое-то количество электричества на формирование двойного электрического слоя вокруг капли (откуда и получаются колебания пера самописца - осцилляции).
Кроме того, при увеличении налагаемого потенциала величина конденсаторного тока возрастает, т.к. двойной электрический слой уплотняется и участок остаточного тока на кривой получается несколько наклонным (участок 1 полярографической волны рис. 33).
Фарадеев ток очень мал. Он возникает вследствие электровосстановления незначительных количеств примесей, присутствующих в растворе и способных разряжаться на электроде при меньших, чем определяемый ион, потенциалах. В первую очередь это растворенный кислород (если не предпринять мер для его полного удаления).
Остаточный ток обычно имеет величину порядка 10-7 А и при анализе малых концентраций веществ (порядка 10-5 М) он оказывается сравним с величиной диффузионного тока, что и ограничивает предельную чувствительность классической полярографии.
При достижении потенциала Е’ - потенциала восстановления определяемых ионов (носящих название ионов деполяризатора, т.к. протекающая электрохимическая реакция направлена против поляризации электрода) они начинают выделяться на ртутной капле с образованием амальгамы:
Ме+n + ne- + Hg à Me(Hg)
и сила тока начинает резко возрастать вследствие потребления энергии на электрохимическую реакцию (участок 2 полярографической волны рис. 33).
В результате электровосстановления концентрация ионов деполяризатора у поверхности ртутного катода уменьшится почти до нуля. Однако за счет диффузии из объема раствора к катоду непрерывно доставляются новые количества ионов. Перенос заряженных частиц приводит к возникновению тока в цепи, который носит название диффузионного тока.
При дальнейшем увеличении напряжения сила тока не уменьшается, хотя ее рост прекращается. Концентрация восстанавливающегося иона в объеме раствора постоянна, концентрация же в прикатодном слое близка к нулю. Разность концентраций в объеме раствора и в прикатодном слое постоянна, что и приводит к постоянной скорости поступления ионов к катоду, определяемой коэффициентом диффузии.
Таким образом, при некотором потенциале Е” скорость разряда ионов на катоде становится равной скорости диффузии ионов из объема раствора в прикатодное пространство. При этом наступает состояние равновесия, которое характеризуется постоянной силой тока, не зависящей от напряжения. Такой ток называется предельным диффузионным током (участок 3 на полярографической волне рис. 33).
Участок 4 характеризуется достижением потенциала восстановления в отношении воды, либо фона. Если это вода, то происходит выделение водорода на катоде и кислорода на аноде, либо, если это сульфат, то опять же это водород и кислород. Естественно, что с аналитической точки зрения для количественного анализа наиболее интересен участок 3.
Количественный полярографический анализ основан на уравнении Ильковича, которое связывает величину предельного диффузионного тока с концентрацией иона и рядом других величин:

Учитывая, что гальванометр, вследствие своей инерционности, показывает не значение самого предельного тока, а только 6/7 и, подставляя значение числа Фарадея F, получаем:

где id – величина предельного диффузионного тока (мкА)
n - число электронов, принимающих участие в
электрохимической реакции
C-концентрация (ммоль/л)
D - коэффициент диффузии (см2/сек)
m – масса ртути, вытекающая из капилляра за 1 секунду (мг)
 - время образования капли (сек).
- время образования капли (сек).
В уравнении Ильковича наиболее трудно определяемой величиной является коэффициент диффузии D. Его значение зависит не только от природы диффундирующего иона, но и от присутствия в растворе посторонних электролитов, а также и от ряда других факторов. Поэтому в практике количественного анализа коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов.
Действительно, при постоянных условиях полярографирования D, m,  и n – постоянны, поэтому получаем уравнение:
и n – постоянны, поэтому получаем уравнение:

Произведение величин  - так называемая постоянная капилляра, зависит от диаметра капилляра, от давления столба ртути в электроде, от температуры, а также от природы определяемого иона и состава фонового электролита.
- так называемая постоянная капилляра, зависит от диаметра капилляра, от давления столба ртути в электроде, от температуры, а также от природы определяемого иона и состава фонового электролита.
Произведение величин  зависит от природы определяемого иона и природы фонового электролита.
зависит от природы определяемого иона и природы фонового электролита.
Воспользовавшись уравнением Ильковича можно определить:
- концентрацию деполяризующего иона
- константу предельного диффузионного тока
- коэффициент диффузии.
Наиболее широко в количественной полярографии применяется метод градуировочного графика. На оси ординат откладывается пропорциональная силе предельного диффузионного тока высота полярографической волны, а по оси абсцисс – концентрация восстанавливающегося иона.
В соответствии с уравнением  калибровочный график должен представлять собой прямую линию проходящую через начала координат, и при исследовании многих систем такой график получается в действительности.
калибровочный график должен представлять собой прямую линию проходящую через начала координат, и при исследовании многих систем такой график получается в действительности.
Метод дает точные результаты при условии идентичности условий полярографирования стандартных растворов и неизвестной пробы. К условиям полярографирования относятся условия работы капилляра, температура и среда (фоновый электролит). Метод калибровочного графика является наиболее трудоемким, но и наиболее точным методом количественной полярографии.
При анализе некоторых систем, для которых применимость уравнения
 установлена вполне надежно, часто применяют метод стандартов, являющийся менее трудоемким. В этом методе в строго одинаковых условиях снимают полярограммы стандартного и анализируемых растворов и из пропорции, основанной на уравнении ( ), рассчитывают неизвестную концентрацию Сх:
установлена вполне надежно, часто применяют метод стандартов, являющийся менее трудоемким. В этом методе в строго одинаковых условиях снимают полярограммы стандартного и анализируемых растворов и из пропорции, основанной на уравнении ( ), рассчитывают неизвестную концентрацию Сх:

где Сст – концентрация стандартного раствора
hx, hст – высота волны при полярографировании, соответственно,
анализируемого и стандартного растворов.
Метод применим только при соблюдении строгой стандартизации условий полярографирования. Преимуществом метода является выигрыш во времени определения. К недостаткам относится возможность ошибки за счет влияния примесей не учитываемых при полярографировании стандартного раствора, а также возможное несовпадение соотношения концентраций фонового электролита и определяемого соединения в стандартном и анализируемом растворах.
Широко распространен в количественной полярографии метод добавок. В известной степени он близок к методу стандартных растворов. Пусть при полярографировании исследуемого раствора сила диффузионного тока равна:
Ix = kCx, или hx = kCx
Добавим к этому раствору известное количество стандартного раствора анализируемого вещества Сст и снова определим величину диффузионного тока:
Ix+ст = k(Cx + Cст) или hx+ст = k(Cx+ Cст)
При почленном делении получаем:

Откуда, без учета разбавления, находим концентрацию анализируемого раствора по соотношению:

При учете разбавления приведенное уравнение примет вид:
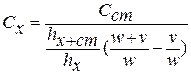
где v – объем анализируемого раствора
w – объем добавки.
Константой диффузионного тока называется величина, получаемая из уравнения Ильковича при делении правой и левой части на одну и ту же величину 
 =K
=K
Величина константы диффузионного тока может быть определена экспериментально из левой части уравнения и рассчитана теоретически из правой части уравнения.
При удовлетворительном совпадении величин константы диффузионного тока найденной экспериментально и полученной расчетным способом из табличных данных, можно говорить, что мы имеем дело с обратимыми процессами и хорошей работе используемого оборудования.
Получив соответствующие экспериментальные данные при постоянных условиях из уравнения 11 можно рассчитать и величину коэффициента диффузии определяемого иона.
Для обратимой полярографической волны зависимость тока от приложенного напряжения описывается уравнением Гейровского-Ильковича:

где Е1/2 – потенциал полуволны, потенциал при котором величина предельного диффузионного тока принимает свое половинное значение
id – предельный диффузионный ток.
При i = ½ id уравнение принимает вид: Е = Е1/2
!Графический способ нахождения величины потенциала полуволны приведен на рис.
 |
Рис. 5. Определение высоты полярографической
волны и величины потенциала полуволны
!Это соотношение показывает независимость потенциала полуволны от величины тока, и, следовательно, от концентрации восстанавливающегося иона.
Потенциал полуволны является, таким образом, качественной характеристикой иона в растворе данного фонового электролита и определение потенциала полуволны составляет основу качественного полярографического анализа.!
Последовательность операций следующая:
- провести касательные к линейным участкам полярографической волны
- через точки пересечения касательных А и В провести прямые, параллельные оси абсцисс, на ось силы тока и разделить полученный отрезок СД пополам
- провести через полученную точку прямую, параллельную оси абсцисс до пересечения с полярографической волной
- из точки К опустить перпендикуляр к оси абсцисс.
Точка пересечения перпендикуляра с осью абсцисс соответствует значению потенциала полуволны.
Значение потенциала полуволны существенно зависит от рН среды и наличия в растворе веществ, способных к комплексообразованию с определяемым ионом. Присутствие в исследуемом растворе лиганда смещает потенциал полуволны в отрицательную область. Это смещение тем больше, чем прочнее комплекс и выше концентрация лиганда. Это значительно расширяет возможности полярографического анализа, позволяя создавать условия для определения нескольких компонентов в одном растворе без их предварительного разделения.
Если в анализируемом растворе содержится несколько веществ, то полярографическая волна (полярограмма) будет состоять из нескольких ступеней, число которых, по крайней мере, равно или больше числа определяемых веществ.
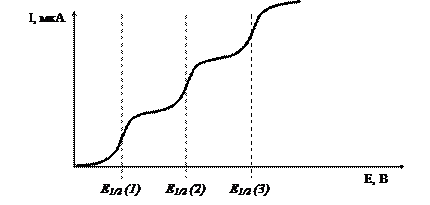 |
Рис.7. Полярографический спектр
Используя эту полярограмму, можно провести как качественный так и количественный анализ смеси веществ. По высоте волны можно определить концентрацию веществ, а по значению потенциала выделения, точнее потенциала полуволны, можно определить вид вещества.
Возможности качественной полярографии не очень высоки, и вот почему. Дело в том, что вся катодная ртутная полярография должна уместиться в интервале напряжений от 0 до -2 В. В области положительных значений потенциала наблюдается электрохимическое превращение ртути, а в области потенциала выше -2 В наблюдается разрушение фона, чаще всего воды, и выделение водорода, и этим лимитируется полярография.
Hgo - 2e à Hg2+ (анодное растворение ртути)
Н2О + 2е à Н2 + О2- (катодное разложение воды)
Полярографический фон и его назначение
Вклад недиффузионных механизмов поступления ионов в прикатодный слой в условиях полярографического определения пренебрежимо мал. Основное значение среди недиффузионных механизмов имеет миграция ионов к катоду под действием электрического поля. Если не устранить вызываемый этим процессом миграционный ток, общий ток окажется неконтролируемым и возможности количественного полярографического анализа будут существенно ограничены.
Подавление миграционного тока достигается введением в анализируемый раствор в достаточной концентрации (в 100 раз большей, чем концентрация определяемого иона) так называемого индифферентного (т.е. не принимающего участия в электродной реакции) или фонового электролита, со значительно более отрицательным потенциалом выделения, чем у анализируемого иона. Катионы фонового электролита располагаются вблизи катода, экранируют заряд электрода, уменьшая тем самым движущую силу миграции под действием электрического поля практически до нуля.
Кроме того, большая концентрация фонового электролита в анализируемом растворе необходима для уменьшения слагаемого iR в уравнении.
С помощью фонового электролита регулируется рН анализируемого раствора введением веществ, усиливающих или подавляющих гидролиз определяемых либо мешающих ионов.
Путем введения в фоновый раствор комплексообразователей достигают эффекта маскировки, если необходимо убрать мешающие ионы, либо наоборот, перевести в комплексную форму определяемые ионы, чтобы сместить потенциал полуволны в ту или иную сторону, для увеличения разрешающей способности полярографического спектра.
Полярографические максимумы
На полярографических кривых довольно часто можно наблюдать максимумы различной формы, возвышающиеся над площадкой предельного тока. Образование максимумов в полярографии, как правило, обусловлено увеличением подачи деполяризатора к электроду вследствие перемешивания раствора. Такие хорошо воспроизводимые максимумы обычно называют вихревыми и по вызывающим их причинам и особенностям разделяют на максимумы первого и второго рода.
Максимумы первого рода образуются на подъеме полярографических кривых в виде острых пиков и наблюдаются, как правило, в разбавленных растворах электролитов.
Максимумы второго рода, наоборот, чаще можно наблюдать в концентрированных растворах электролитов при больших скоростях вытекания ртути из капилляра и не имеют остроконечной формы.
 |
Рис.11. Максимумы первого (а) и второго рода (б) на полярограммах
В этом случае количественный полярографический анализ становится почти невозможным.
Наиболее полно появление максимумов объясняет теория академика Фрумкина. Согласно этой теории, причиной возникновения максимумов является движение поверхности ртутной капли, происходящее под влиянием разницы в величинах поверхностного натяжения на различных участках поверхности капли.
Связь между потенциалом и поверхностным натяжением ртутной капли описывается электрокапиллярной кривой (12).
 |
Рис. 12. Электрокапиллярная кривая
До максимума электрокапиллярной кривой с повышением напряжения Е поверхнотсное натяжение возрастает – возрастающий (положительный) участок кривой, а за ним падает – нисходящий участок кривой (отрицательный).
Неравномерное распределение зарядов на поверхности экранированной капли ртути обуславливает неравномерность поверхностного натяжения вдоль капли, в результате чего поверхностный слой ртути двигается к местам с более высоким поверхностным натяжением, вовлекая в движение и прилегающий раствор. Следовательно ион-деполяризатор доставляется к электроду не только путем диффузии, но и за счет конвекции, что и приводит к появлению максимума.
Если капля ртути служит катодом, а анод расположен под каплей, то нижняя часть капли, где плотность тока и, следовательно, поляризация наибольшие, имеет более отрицательный потенциал, чем у шейки капли. Если потенциал электрода соответствует положительной ветви электрокапиллярной кривой, как это имеет место в случае положительных максимумов, то поверхностное натяжение внизу капли больше, чем около шейки, и, следовательно, поверхность ртути перемещается от шейки капли к нижней ее части, увлекая за собой прилегающий слой раствора в том же направлении (рис. 13 а).
 |
Рис. 13. Движение раствора и ртути под действием разности поверхностных натяжений (а,б) и под действием вытекания ртути (в)
Вследствие конвекции раствора к шейке капли подаются свежие порции деполяризатора, тогда как к нижней ее части подходит раствор, частично обедненный деполяризатором, в результате чего еще больше увеличивается разность потенциалов между нижней частью и шейкой капли.
В случае отрицательных максимумов, когда потенциал электрода лежит в отрицательной ветви электрокапиллярной кривой, нижняя часть капли также имеет более отрицательный потенциал, однако теперь поверхностное натяжение больше около шейки капли и, следовательно, поверхность ртути перемещается от нижней части капли к ее шейке (рис. 13б). Таким образом, в этом случае свежий раствор подходит к капле снизу, а к шейке доставляется частично уже обедненные его порции, вследствие чего шейка капли поляризуется в большей мере, и разность потенциалов вдоль поверхности ртути уменьшается. Именно этим объясняется то обстоятельство, что отрицательные максимумы, как правило, меньше положительных.
Одной из причин появления максимумов первого рода на полярографических волнах является участие растворенного кислорода в электродной реакции, протекающей в две стадии:
при потенциале –0.09 – 0.118 В О2 + 2Н+ + 2e- à H2O2
при потенциале –0.9 В Н2О2 + 2 Н+ + 2е- à 2Н2О
Мешающее влияние кислорода устраняется продувкой полярографируемого раствора током газообразного азота, или путем прибавления к исследуемому раствору сульфита натрия или аскорбиновой кислоты, химически связывающих растворенный кислород.
Причиной возникновения максимумов второго рода является движение ртути внутри самой капли, вызываемое процессом вытекания ртути из капилляра. Такое движение вызывает перемешивание раствора и возникновение максимума на вольтамперной кривой. Этот максимум, проявляющийся в концентрированных растворах, при работе с быстрокапающими капиллярмаи, имеет более сглаженную форму и проявляется при всех потенциалах (рис. ).
Для устранения максимумов как первого, так и второго рода в исследуемый раствор добавляют поверхностно-активные вещества: желатин, агар-агар и другие органические вещества с большим молекулярным весом. Добавляемые к раствору поверхностно-активные вещества адсорбируются на поверхности капли; в результате перемещения слоев ртути и раствора они накапливаются в местах наиболее высокого поверхностного натяжения, понижают его и тем самым препятствуют движению ртути и раствора.
Полярографические максимумы, затрудняющие измерение высот и потенциалов полуволн полярографических кривых, в случае обычных аналитических определений, благодаря их высокой чувствительности к присутствию поверхностно-активных веществ в растворах, могут с успехом применяться для количественного определения полярографически неактивных веществ, которые способны адсорбироваться на ртути. Данный метод дает возможность определять до 0.0001 % загрязнений.
Электроды в полярографии
Помимо ртутных электродов в практике вольтамперометрии нашли и твердые микроэлектроды, в частности из благородных металлов и графита. Достоинствами ртутных электродов являются возобновляющаяся поверхность, обеспечивающая стабильность работы электрода, а также высокое перенапряжение водорода, позволяющее работать в области отрицательных потенциалов, а недостатками данного вида электродов является ядовитость ртути.
Твердые микроэлектроды из платины, золота, графита позволяют работать в области положительных потенциалов (-0.3 В - +1.8 В) расширяя возможности индикаторного электрода в вольтамперометрии.
В соответствии с первым законом Фика, диффузионный ток описывается уравнением:

где n – число электронов, участвующих в электрохимической реакции
F - число Фарадея
D – коэффициент диффузии иона
Cs – концентрация ионов в растворе
Со – концентрация ионов у поверхности электрода
 - толщина диффузионного слоя (приэлектродной пленки)
- толщина диффузионного слоя (приэлектродной пленки)
Для предельного диффузионного тока уравнение имеет вид:

Как следует из уравнения ( ) увеличение поверхности (площади) электрода приводит к увеличению чувствительности определения. Однако увеличение размеров электрода должно производится в пределах, обеспечивающих выполнение одного из основных условий полярографии: плотность тока на катоде должна быть гораздо больше плотности тока на аноде (что обеспечивается разностью в размерах электродов), иначе не соблюдается пропорциональность между предельным диффузионным током и концентрацией.
Другим способом увеличения чувствительности определения является () как видно из уравнения ) уменьшение толщины диффузионного слоя 
 . Для этих целей твердые микроэлектроды делают вращающимися, вибрирующими или неподвижными, но погруженными в движущуюся жидкость.
. Для этих целей твердые микроэлектроды делают вращающимися, вибрирующими или неподвижными, но погруженными в движущуюся жидкость.
При движении электрода в анализируемом растворе на поверхности твердого микроэлектрода всегда остается неподвижная пленка относительно подвижной части электрода. Эта пленка и выступает в роли диффузионного слоя.
Для подвижных твердых микроэлектродов зависимость между предельным диффузионным током и концентрацией описывается уравнением
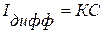
но величина К зависит не только от констант уравнения Ильковича, но также от целого ряда других факторов: от конструкции электрода, скорости и формы вращения электрода и др.
Существенным недостатком твердых микроэлектродов является осаждение продуктов электрохимической реакции на поверхности электрода, приводящие как к качественным, так и к количественным (площадь активной поверхности) изменениям. Поэтому после каждого определения производится очистка поверхности твердых микроэлектродов различными способами: механическим, химическим и электрохимическим.
При механическом способе очистки поверхность электрода очищают бритвой, наждачной или фильтровальной бумагой, срезая торцевую часть поверхности (это касается электродов из графита).
Наиболее распространенными способами химической очистки электродов является обработка их горячей азотной кислотой (1:1), с последующей тщательной промывкой дистиллированной водой.
Однако наиболее совершенным, быстрым и дающим воспроизводимое состояние поверхности является электрохимический способ очистки при помощи переключателей, приводящей к гальванической деполяризации.
Разновидности полярографии
Рассмотрение разновидностей вольтамперометрии начнем с дифференциальной полярографии.
В дифференциальной полярографии анализ ведется по полярографическим кривым  , при сохранении электрохимического режима прямой классической полярографии.
, при сохранении электрохимического режима прямой классической полярографии.
Принципы дифференциальной полярографии основаны на следующих зависимостях:
- из уравнения полярографическо волны

следует
 .
.
Решая это уравнение относительно  , получаем:
, получаем:
 .
.
Производная этого уравнения по Е при  дает соотношение:
дает соотношение:
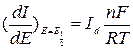 .
.
Из данного соотношения следует, что потенциал Е, соответствующий максимальному значению производной  , является потенциалом полуволны, определяющим природу вещества, высота максимума
, является потенциалом полуволны, определяющим природу вещества, высота максимума  пропорциональна предельному диффузионному току
пропорциональна предельному диффузионному току  и, следовательно, концентрации вещества.
и, следовательно, концентрации вещества.
Метод дифференциальной полярографии позволяет устранить влияние остаточного тока, а также позволяет увеличить на порядок разрешающую способность метода.
Например, на фоне 2 М KNO3 можно раздельно определить свинец (  ) и таллий
) и таллий  ), разница потенциалов полуволн у которых составляет всего 0,06 В; на фоне 1 М КСl можно раздельно определить цинк и никель, разница потенциалов полуволн у которых равна 0,085 В и др.
), разница потенциалов полуволн у которых составляет всего 0,06 В; на фоне 1 М КСl можно раздельно определить цинк и никель, разница потенциалов полуволн у которых равна 0,085 В и др.
 |
Рис. 8. Полярографический спектр при классической (а) и дифференциальной
полярографии (б)
Следующая разновидность вольтамперометрии, на которой мы остановимся, это инверсионная вольтамперометрия, или еще ее называют амальгамная полярография с накоплением или полярография анодного растворения.
Сущность метода состоит в предварительном накоплении определяемого вещества (металла) на катоде (представленном висящей ртутной каплей при постоянном потенциале, отвечающем величине предельного диффузионного тока данного иона) с последующим электрохимическим растворением при линейно снижающемся потенциале.
Ме(Нg) + ne 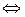 Me+n + Hg
Me+n + Hg
Процесс проведения накопления и растворения иллюстрирует рис. 9.

Рис. 9. Амальгамная полярограмма с накоплением:
1 – накопление при постоянном потенциале (масштаб тока на несколько порядков больше, чем при регистрации)
2 – растворение
h – высота полярографической волны
Допустим, объем анализируемой пробы 30 мл, а объем капли составляет 0.01 мл, т.е. нижний предел обнаружения уменьшается на несколько порядков. Время концентрирования зависит от ориентировочной исходной концентрации и составляет от нескольких минут до одного часа. Нужно иметь в виду, что максимально определяемые данным методом концентрации составляют порядка 10-7 М, а минимальные – порядка 10-10 М. Особое внимание необходимо обращать на чистоту используемых химических реактивов, воды и посуды.
В практике инверсионной вольтамперометрии нашли применение и твердые микроэлектроды из углеродистых материалов. Накопление определяемого вещества на данных электродах происходит за счет процессов адсорбции или образования труднорастворимых соединений.
Осциллографическая вольтамперометрия (вольтамперометрия с быстрой разверткой потенциала)
В данной разновидности вольтамперометрии скорость наложения поляризующего напряжения делается достаточно большой, и достигает порядка 100 мВ/сек, против 2-5 мВ/сек в классической полярографии. Запись полярограммы производится во второй половине жизни капли, уменьшая таким образом влияние конденсаторного тока. Для таких высоких скоростей развертки при регистрации силы тока вместо гальванометра используется осциллограф. Отсюда и название разновидности данного метода.
Осциллографическая полярограмма, полученная для одного иона изображена на рис.
Рис. 8. С. 78
Потенциал максимума на этой кривой  является качественной характеристикой иона, а высота максимума
является качественной характеристикой иона, а высота максимума  пропорциональна концентрации иона.
пропорциональна концентрации иона.
Появление максимума на данной вольтамперной кривой объясняется следующим образом. При малых напряжениях электрохимический процесс отсутствует и ток близок к нулю (остаточный ток). Начиная с напряжений, достаточных для протекания электрохимической реакции, градиент концентраций вблизи поверхности электрода увеличивается, что сопровождается возрастанием тока через ячейку. Одновременно с этим идет продвижение фронта диффузии вглубь раствора, противодействующее увеличению тока. Начиная с определенного напряжения, преобладающее влияние оказывает второй фактор и ток ячейки, пройдя через максимум, падает.
Столь быстрая скорость протекания электрохимической реакции приводит к увеличению чувствительности на порядок, по сравнению с классической полярографией.
Следующая разновидность вольтамперометрии – переменнотоковая полярография
В этом методе на электроды, помимо постоянного тока, подается еще переменная составляющая сравнительно небольшого напряжения (порядка 30 мВ) различной формы: синусоидальной, квадратной, пилообразной и др.
Налагаемое во времени на ячейку постоянное напряжение можно представить возрастающей прямой 1 (рис. а). На постоянное напряжение накладывается переменное, в данном случае синусоидальное напряжение (кривая 2)
Рис.
В соответствии с колебаниями переменного тока вольтамперная зависимость будет иметь вид (рис. б), т.е. мы имеем бесконечно большое количество полярограмм между предельными полярограммами 1 и 2. Разность токов, при данном потенциале, между этими предельными кривыми дает значение дифференциального тока, фиксируемого в виде переменнотоковой полярограммы (рис. с. 81, подправить)
 |
Рис. 10. Переменно-токовая полярограмма
Потенциал пика соответствует потенциалу полуволны и определяет природу восстанавливающегося вещества, а высота пика – его концентрацию.
Количественная зависимость высоты пика, или максимального значения амплитуды переменного тока Iмакс от концентрации вещества выражается формулой:
Iмакс = КС
где величина К зависит не только от коэффициента диффузии, заряда иона деполяризатора и др., а также от формы переменного напряжения.
Дифференциальная форма вольтамперной кривой в переменнотоковой полярографии увеличивает разрешающую способность, а сочетание переменного и постоянного токов позволяет устранить влияние конденсаторного тока, что увеличивает чувствительность определения на два порядка по сравнению с классической полярографией.
Еще одной разновидностью полярографии является импульсная вольтамперометрия.
Идея импульсной полярографии предложена Баркером в 1957 году и является дальнейшим развитием метода разделения емкостного и диффузионного токов, что приводит к дальнейшему увеличению чувствительности метода.
Существует две разновидности импульсной полярографии: нормальная и дифференциальная.
В нормальной импульсной полярографии ртутный капельный электрод поляризуют линейно увеличивающимися импульсами, налагающимися на некоторый начальный постоянный потенциал (базовый), который выбирается таким образом, чтобы электролиза не происходило.
После появления из капилляра капли с периодом жизни tm через некоторое время на электрод налагается импульс прямоугольного напряжения DЕ (обычно около 3 мВ) длительностью 40-100 миллисекунд (рис. 1 ).
Рис. 1 с. 84
Потенциал электрода становится равным Ео + DЕ. В конце этого периода импульс снимается и потенциал ртутного капающего электрода вновь приобретает значение Ео. Ток измеряется перед самым окончанием импульса (до отрыва капли). Капля отрывается вслед за окончанием импульса поляризации DЕ. С появлением новой капли весь цикл поляризации повторяется точно также, за исключением того, что величина DЕ больше.
В конце каждого периода жизни ртутной капли, когда ее поверхность уже почти не меняется ( рис. 2), на электрод подается прямоугольный импульс напряжения  длительностью 0.04 сек.
длительностью 0.04 сек.
Рис. 2 с.84
Измерение тока производится в конце каждого импульса напряжения, когда емкостной ток практически равен нулю (рис. 3). При этом нижний предел обнаружения уменьшается до 10-7 М.
Рис. 3 с. 84
При этом вольтамперная зависимость носит вид обычной S-образной кривой и обработка ее для качественных и количественных определений проводится как и в классической полярографии.
В дифференциальной импульсной полярографии базовый потенциал от капли к капле не является постоянным, а медленно и линейно возрастает во времени (рис. 4)
Рис. 4 с. 86
На этот потенциал налагается импульс прямоугольной формы DЕ величиной 10-100 мВ и поддерживается постоянным относительно базового уровня Е. Импульс налагают в определенный момент жизни капли с приблизительно такой же длительностью, как и в случае нормальной импульсной полярографии. Измерение тока производят дважды в течение жизни каждой капли: первый раз это измерение производится перед началом самого импульса (t1), а второй раз – во второй половине времени импульса, для исключения емкостного тока перед отрывом капли (t2)
(рис. 5 с. 86)
Поскольку в этом варианте метода прибор регистрирует разность токов в момент t2 и t1, то вольтамперная кривая имеет вид дифференциальной полярограммы, что увеличивает разрешающую способность метода, а с другой стороны увеличивает нижний предел обнаружения до 10-8 М, что определяет большие возможности аналитического применения метода.
Амперометрическое титрование
Одной из важнейших разновидностей полярографии является амперометрическое титрование. Суть его заключается в том, что в растворе протекает реакция титруемого вещества с титрантом, и точку эквивалентности в этой реакции регистрируют полярографически. Как и в потенциометрическом титровании, расчет концентрации проводят по фактическому аналитическому сигналу - объему титранта, который всегда можно довольно точно измерить.
Полярографически активными в амперометрическом титровании могут быть, как титруемое, так и титрант, а также продукты реакции. В этом случае обычно процесс полярографирования проводят с твердыми вращающимися либо вибрирующими электродами, обычно графитовыми или платиновыми.
Поскольку можно использовать полярографически активный титрант, то удается определить и неполярографически активные вещества, т.е. появляется некоторая универсальность. Процесс ведут следующим образом: вначале выбирают значение потенциала, при котором достигается предельное значение диффузионного тока хотя бы для одного из участников реакции титрования. Далее при этом постоянном потенциале проводят титрование и строят зависимость силы тока от объема титранта. Эта зависимость I от V имеет четко выраженные изломы при реакциях идущих до конца. Возможны следующие случаи:
 |  | ||
 |  |
Рис. 12. Формы кривых амперометрического титрования
а – электродоактивен титрант
б – электродоактивно определяемое вещество
в – электродоактивен продукт реакции
г – электродоактивны титрант и продукт реакции
В амперометрическом методе наиболее часто используют реакции окисления-восстановления и осаждения. Наиболее интересный пример – это амперометрическое титрование смеси солей свинца и бария хромат - ионом.
В данном случае определение содержания катионов основано на различной растворимости солей. Полярографически активным является одно из титруемых веществ - свинец. Барий не является полярографически активным. В начале титруется свинец, он осаждается первым. Это первая точка эквивалентности. Далее титруется барий, при этом в растворе вообще нет полярографически активного вещества, а есть только фон. Далее, когда барий оттитровался, в растворе есть хромат ион, и наблюдается рост силы тока.
 |
Рис. 13. Кривая титрования смеси солей
свинца и бария хромат-ионом