 |
|
Функциональную зависимость I от t построить еще сложнее, но с этой задачей ЭВМ может справиться с определенной долей приближения.
Существует второй вариант кулонометрии. Это работа при постоянной силе тока. Есть современные электронные системы, которые регулируют потенциалы так, чтобы сила тока оставалась постоянной. В этом случае строят графическую зависимость потенциала, необходимого для создания данной силы тока, от времени t. Так как сила тока постоянна, то надо найти такое значение t, когда все вещество вступит а электрохимическую реакцию. Начальный потенциал постоянен, но в точке, когда заканчивается разрушаемое вещество, будет наблюдаться скачок. Он будет тем больше, чем выше выход по току, т.е. чем меньше присутствующих примесей. Тогда I является const и q = I t .
 |
Рис. 15. Форма кривой кулонометрического
титрования при постоянной силе тока
Наиболее широко применяется третий вариант кулонометрического метода анализа, в котором используют химический измеритель количества электричества. Параллельно с определяемым веществом ставят ячейку с раствором CuSO4 Процесс проводят до скачка потенциала при постоянной силе тока либо до изменения окраски какого- либо индикатора, чувствительного к определяемому веществу. В этом случае количество электричества в ячейке с CuSO4 будет одинаково, так как сила тока одна и та же. Предварительно определяют вес катода. Далее взвешивают катод с осажденной на нем медью и находят количество меди, осажденное на катоде. Зная эквивалент меди, находят количество электричества и используют его в расчетах. Такое возможно, так как при выделении Сu наблюдается близкий к 100% (99.9%) выход по току.
Кулонометрическое титрование называют еще методом возникающихреагентов. Например, необходимо определить содержание тиосульфата. Заливают в анализируемый раствор КI и тиосульфат. Затем пропускают электрический ток. На анод подают потенциал, достаточный для окисления I- - ионов до I2 , далее I2 реагирует с тиосульфатом:
2 КI - 2e® 2 K + + I2
I2 + S2 O3 2- ® S4 O62- + 2 I-
Точку эквивалентности фиксируют по крахмалу или по скачку потенциала при постоянной силе тока. Достоинство этого метода в том, что удается довести выход по току до 100%, имея большой избыток исходного вещества, в данном случае КI. Броматометрия так же может быть осуществима кулонометрически. В этом случае избыток KBr окисляется до Br2 (анодное окисление). Далее Br2 реагирует с оксихинолином, ихбыток Br2 фиксируется с индикатором.
Кондуктометрия
Кондуктометрический метод анализа основан на измерении удельной электропроводности анализируемого раствора. Электропроводностью называют величину, обратную электрическому сопротивлению. Единицей измерения электропроводности является ом-1. Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома. Сопротивление раствора прямо пропорционально расстоянию между электродами d и обратно пропорционально площади их поверхности А:
R = p d (9)
A
где p – удельное сопротивление.
При d =1 см и А=1 см2 имеем R=p, следовательно, удельное сопротивление равно сопротивлению 1 см3 раствора.
Величину, обратную удельному сопротивлению, называют удельной электропроводностью:
c = 1 (10)
р
Удельная электропроводность (Ом. см-1) численно равна току (в А), прошедшему через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1 в на единицу длины.
Графическая зависимость c от с имеет следующий вид
 |
Рис. 16. Зависимость величины удельной
электропроводности от концентрации
На графике имеется стандартное отклонение c 0, которое вызвано проводимостью фона либо примесей (например, СО32-, Н+ - ионов). В области высоких концентраций наблюдается отклонение в нижнюю сторону, которое связано со снижением коэффициента активности. Кстати, метод кондуктометрии является одним из самых распространенных методов определения средних коэффициентов активности. В таблицах имеются данные по средней удельной электропроводности солей и по удельной электропроводности ионов. Как вы думаете, как можно разделить электропроводность соли на составляющие: электропроводность катиона и электропроводность аниона?
Существует прием, который заключается в том, что принимают равными электропроводности или подвижности каких-либо ионов, например К+ и Сl- . Если принять такое допущение за основу, то электропроводность равна сумме двух равных частей. Комбинируя соли с этими стандартными ионами, определяют электропроводности и всех остальных ионов. Иногда в качестве стандартов используют тетрафенилборат и тетрафениламмоний.
Надо отметить, что c связана с концентрацией через эквивалентную электропроводность. Если величина c = 1, то это сопротивление в 1 ом кубика, где имеются два электрода площадью в 1 см2 и между ними расстояние в 1 см.
Следующее понятие – это эквивалентная электропроводность, которая рассчитывается по формуле:
cэкв. = c /с ,
где с – концентрация в моль/л.
Эквивалентная электропроводность уменьшается с повышением концентрации раствора. Существует еще понятие электропроводности идеального раствора при (бесконечном разбавлении раствора) c 0..
В физико-химических методах часто пользуются уравнением Кольрауша:
c = c 0 - а с ,
где с – концентрация в моль/л, а –коэффициент.
 |
Рис.17. Зависимость эквивалентной электропроводности
от концентрации
До значения 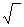 с = 0 дойти невозможно, поскольку,
с = 0 дойти невозможно, поскольку, 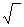 с = 0 - это чистый растворитель, но обычно растворитель имеет фоновую проводимость. Экстраполяция линейного участка кривой и дает c 0 , а c 0 является суммой предельной эквивалентной проводимости аниона и катиона, которые табулированы.
с = 0 - это чистый растворитель, но обычно растворитель имеет фоновую проводимость. Экстраполяция линейного участка кривой и дает c 0 , а c 0 является суммой предельной эквивалентной проводимости аниона и катиона, которые табулированы.
Метод электропроводности в прямом варианте используется как метод анализа в двух случаях:
1. метод определения солености воды, метод определения засоленности почв;
2. использование для контроля чистых вод: дистиллята, бидистиллята и деионизированной воды.
Классический случай применения кондуктометрии – это вариант титрования с индикацией точки эквивалентности по электропроводности. Такая кривая титрования может быть получена, если титровать НСl раствором NaOH.
 |
Рис. 18. Кривая кондуктометрического
титрования раствора НСl раствором NaOH
До нуля график не опускается, так как в точке эквивалентности присутствует NaCl, который хоть и слабо, но проводит электрический ток.
Более правильный случай можно изобразить при титровании смеси сильной и слабой кислот.
 |
Рис. 19. Кривая кондуктометрического титрования
cмеси сильной и слабой кислот раствором NaOH
Такие случаи рассматриваются в учебниках.
Надо отметить, что кондуктометрическое титрование чаще всего осуществляют на переменном токе. Почему? Дело в том, при работе на постоянном токе между электродами будут проходить электрохимические процессы разложения вещества. Этот процесс является помехой. При переменном токе эти процессы далеко не проходят и практически не влияют на электропроводность. Обычно в стакан вставляют два платиновых или платинированных электрода.
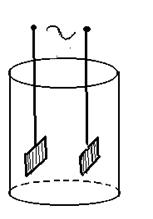 |
Рис. 20
Этот метод нашел развитие в хроматографии (детекторы).
В 1970 году начала развиваться ионная хроматография. Причиной ее развития было то, что ионы можно легко детектировать по электропроводности.
Электровесовой метод анализа
Электровесовой метод анализа применяется значительно чаще, чем кулонометрический метод анализа, хотя им определяют обычно 1-2 элемента.
Суть его заключается в том, что на одном из электродов (катоде или аноде) количественно выделяют определяемое вещество. После тщательной промывки вещества в воде, ацетоне, диэтиловом эфире его высушивают и взвешивают. После этого снимают с поверхности электрода определяемое вещество и взвешивают сам электрод. Разность дает массу определяемого вещества. Достоинство электровесового метода - это его высокая точность –1-2 %. Это не соответствует точности весового анализа. Почему? Чаще всего на аноде осаждают PbO2 и определяют свинец при умеренных концентрациях, но точно. На катоде чаще всего осаждают медь, иногда благородные металлы.
В основном этот метод известен как метод определения Сu. Электровесовым методом Сu определяют с точностью до 0,05 % . Но этот метод не получил бы такого широкого распространения, если бы не анализ сплавов. В 70-е годы кафедра аналитической химии была одной из ведущих лабораторий СССР по стандартизации сплавов (латуни и стали). Известно, что стандартные образцы являются показателем уровня развития страны. Стандартные образцы делались следующим образом: изготавливали латунную болванку весом в 1 тонну, в которой примерно задавались требования к концентрациям меди, цинка и примесям (около двадцати металлов). Эта болванка распиливалась до порошкообразного состояния и проверялась на однородность. Если однородность была недостаточной, то необходимо было повторять весь этот процесс. Если же однородность состава удовлетворяла предъявляемым требованиям, то изготавливали образцы по 100 г.
Эти образцы анализировались двумя исполнителями двумя методами в 10-15 лабораториях. Берется 6 навесок, т.е. проводится 24 определения на каждый элемент. Затем проводится математическая обработка данных, третья часть их выбраковывается. Такой стандартный образец по цене приближается к стоимости золота. А золотой образец, приготовленный таким образом, стоит в 10 раз дороже обычного золота.
Пусть необходимо определить медь с точностью 0.05 %. Определение проводится следующим образом: медь выделяют на катоде на 99 %, а оставшийся в растворе 1 % меди определяют другим, менее точным, методом. Чаще всего это фотометрия с диэтилдитиокарбоматом. Весовой метод гарантирует точность определения основ до 0.01 %, а 1 % определяется неточно - + 5 % . Общее определение меди проводится с точностью 0.05 % -0.1 %.