 |
|
ОСНОВНЫЕ ПРОЦЕССЫ ПРИМЕНЯЕМЫЕ НА ПРАКТИКЕ
ПАРОКОМПРЕССИОННЫЕ ХОЛОДИЛЬНЫЕ МАШИНЫ
Парокомпрессионные холодильные машины имеют наибольшее применение для охлаждения в широком интервале температур: от 278 К (одноступенчатые холодильные машины) до 113 К (каскадные холодильные машины). Их холодопроизводительность охватывает диапазон от нескольких десятков ватт (домашние холодильники) до нескольких тысяч киловатт (холодильные машины с центробежными компрессорами). Основной особенностью парокомпрессионных холодильных машин является то, что рабочее вещество, совершая обратный цикл, меняет свое агрегатное состояние и может находиться в состоянии влажного, сухого насыщенного или перегретого пара, а также в жидком состоянии. В качестве холодильных агентов (рабочих веществ) применяются вещества с низкой нормальной температурой кипения. В основном на крупных установках применяется аммиак, на малых и средних установках различные хладоны (фреоны). Основными элементами холодильной машины являются: компрессор, конденсатор, испаритель и устройство, в котором происходит расширение рабочего вещества.
ТЕПЛОИСПОЛЬЗУЮЩИЕ ХОЛОДИЛЬНЫЕ МАШИНЫ
Теплоиспользующие холодильные машины нашли широкое применение в различных отраслях промышленности. К ним относятся пароэжекторные (ПЭХМ), абсорбционные (АХМ) и сорбционные холодильные машины. Отличительной особенностью перечисленных типов машин от парокомпрессорных и газовых холодильных машин является принцип получения в них холода за счет использования теплоты греющих источников. Для привода насосов в ПЭХМ и АХМ необходимо небольшое количество электроэнергии, которое практически не учитывают в их тепловых балансах. В ПЭХМ и АХМ искусственный холод вырабатывается с помощью системы совмещенных прямого и обратного циклов.
В ПЭХМ совмещены пароэнергетическая установка с двигателем-эжектором и холодильная машина со струйным компрессором-эжектором. Пароэнергетическая установка включает в себя парогенератор, эжектор, конденсатор и насос. В состав холодильной машины входят эжектор, конденсатор, дроссельный (регулирующий) вентиль и испаритель.
В теоретической схеме АХМ функцию пароэнергетической установки выполняют генератор, расширительная машина (турбина), абсорбер, насос и растворный детандер. Функцию холодильной машины выполняют испаритель, компрессор, конденсатор и детандер. В действительной схеме АХМ расширительная машина в прямом цикле и компрессор в обратном взаимно исключают друг друга, а детандеры заменяются на дроссельные вентили. В результате получается единый контур теплоиспользующей машины - АХМ с совмещенными прямым и обратным циклами.
ЛЕКЦИЯ 4
«АБСОРБЦИОННЫЕ ХОЛОДИЛЬНЫЕ МАШИНЫ»
Абсорбция
Одним из основных процессов АХМ является абсорбция, которая в общем виде представляет собой поглощение газа (пара) жидким поглотителем (абсорбентом). В абсорбционных процессах участвуют две фазы - жидкая и газовая, и происходит переход вещества из газовой фазы в жидкую. При протекании абсорбционных процессов поверхность соприкосновения фаз должна быть как можно большей, что реализуется в конструкциях абсорбционных аппаратов.
Движущей силой процесса переноса вещества является отклонение системы от равновесия. Применительно к АХМ в паровой фазе ею является разность давлений пара хладагента в общем объеме и непосредственно у поверхности соприкосновения фаз, в жидкой фазе - разность концентраций хладагента у поверхности контакта фаз и в общем объеме абсорбента.
Вследствие разности давлений молекулы пара подлетают к поверхности соприкосновения фаз и захватываются (притягиваются) абсорбентом. Это происходит в результате того, что в растворе между молекулами абсорбента и хладагента всегда имеет место физическое взаимодействие, выражающееся во взаимном притяжении молекул. На поверхности абсорбента пар хладагента превращается в жидкость с выделением теплоты фазового перехода. И далее жидкий хладагент в результате наличия градиента концентраций растворяется в абсорбенте с выделением теплоты растворения. Таким образом, теплота абсорбции на 1 кг хладагента в основном включает в себя удельную теплоту конденсации хладагента и дифференциальную теплоту растворения хладагента в абсорбенте.
При абсорбции чистых компонентов, что имеет место в АХМ, сопротивление переносу массы преимущественно определяется сопротивлением жидкой фазы, зависящим, как правило, от молекулярной и конвективной диффузий хладагента в абсорбенте.
Эффективность применения теплоиспользующих холодильных машин в значительной степени зависит от стоимости теплоты греющих источников, требуемых температурных потенциалов и практически всегда является высокой при использовании вторичных энергетических ресурсов (ВЭР), а также при одновременной выработке холода и теплоты.
Схема и принцип работы ХМ
На рис. 1 представлена схема абсорбционной холодильной машины, которая может работать на бинарных смесях как первого, так и второго типа.
Раствор с большим содержанием легкокипящего компонента, образующийся в абсорбере, поступает в насос при давлении кипения, где его давление повышается до давления конденсации. За счет работы насоса к раствору подводится тепло qи. Концентрация раствора при этом не изменяется. Из-за несжимаемости жидкости энтальпия раствора до и после насоса остается постоянной.
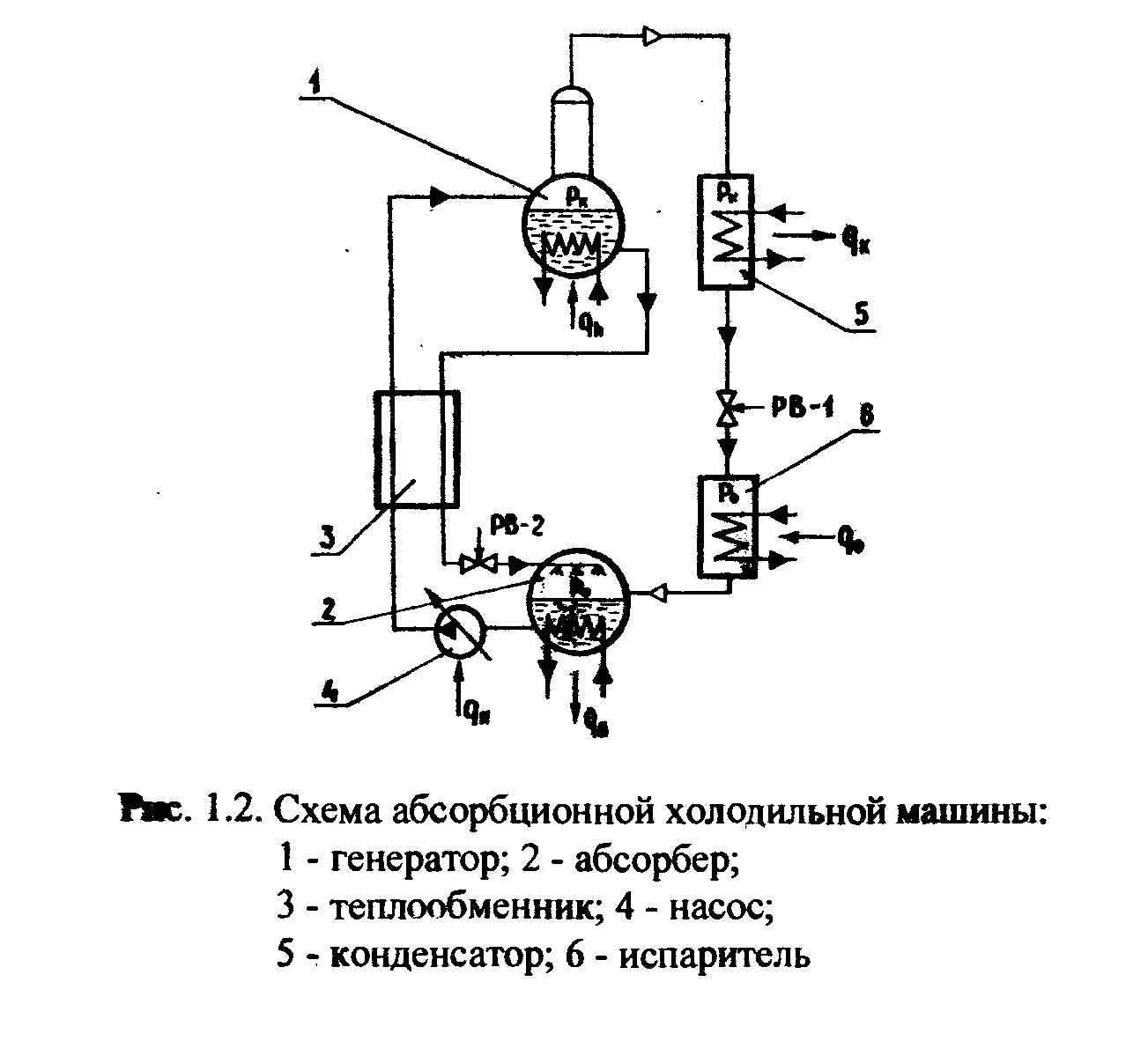
В рекуперативном теплообменнике раствор подогревается и с измененной концентрацией подается в генератор. В генераторе при подводе тепла qh от греющего источника раствор кипит, его концентрация по легкокипящему компоненту уменьшается.
В абсорбционной машине, работающей на бинарных смесях первого типа, образующийся пар подвергается очистке в процессе ректификации, происходящей в специально предусмотренной для этого части генератора.
Пар из генератора направляется в конденсатор, где сжимается при давлении Рк и отводе тепла конденсации qк. Затем жидкость дросселируется в регулирующем вентиле РВ-1. При этом давление снижается от Рк до Р0. Процесс дросселирования происходит при постоянной энтальпии и концентрации. Холодильный агент переходит из состояния переохлажденной жидкости в состояние влажного пара и поступает далее в испаритель, где кипит при подводе тепла qа. Концентрация по легкокипящему компоненту повышается, и на этом цикл замыкается.
Таким образом, можно считать, что абсорбер является всасывающей стороной компрессора, а генератор – нагнетательной.
Уравнение теплового баланса одноступенчатой абсорбционной холодильной машины:
qh + q0 + qи = qк + qa + (qR),
где qR – тепло, отводимое от пара при очистке его в дефлегматоре при работе абсорбционной холодильной машины на бинарной смеси холодильного типа.
Эффективность работы абсорбционной холодильной машины оценивается тепловым коэффициентом
ξ = q0/qh
Два вида холодильных машин:
1. Водоаммиачные (Н20+NH3)
2. Бромисто-литиевая абсорбционная машина (LiBr+Н2О)
Абсорбционные бромисто-литиевые холодильные машины (АБХМ)применяется при температурах кипения tо > 0 оС. Охлаждение до 2-4 оС происходит за счет кипения воды при давлении 5-6 мм рт ст. АБХМ могут работать на бросовом тепле, что делает применение их в данном режиме крайне экономичным. ПВ отличие от водоаммиачных более компактны и имеют меньшую массу, но рабочие процессы в них подобны. Из-за коррозионной активности LiBr кипятильник и абсорбер изготавливают из медно-никелевого сплава или коррозионно-стойкой стали, а кожухи аппаратов изнутри покрывают слоем никеля и несмотря на это в системе должны быть ингибиторы. Ингибиторами являются хромат, арсенат, молибдат лития.
Для объяснения сущность физико-химического процесса получения холода в АБХМ воспользуемся рисунком 1.

Рисунок 1. Простейшая схема АБХМ
(P2 = Р1, T2 > T1)
Основными элементами в АБХМ являются испаритель () и абсорбер (). В испарителе, содержащем разбавленный раствор LiBr, создается вакуум, достаточный для кипения раствора при температуре Т1. Пары воды поглощаются в абсорбере концентрированным раствором LiBr, что приводит к его нагреву до Т2 и разбавлению раствора. Для восстановления концентрированного раствора он пропускается через теплообменник для нагрева , под действием внешнего источника энергии (горячая вода, пар, выхлопные газы, теплота сгораемого топлива и др.), далее попадает в генератор, где излищки воды испаряются. Концентрированный раствор снова попадает в абсорбер и цикл повторяется.
Преимущества АБХМ: отсутствие компрессора, что делает его бесшумным и исключает вибрацию, экономичность, высокая надежность, долговечность и экологическая чистота.
Адсорбция – это поглощение на поверхности.
Абсорбция – это поглощение всем объемом абсорбента.
1. Свойства водоаммиачных растворов.

Т2>T1
Н2О выполняет функцию растворителя.
NH3 – растворенного вещества.
Теплофизические характеристики аммиака:
- Мольная масса М(NH3)=17г/моль
-Критическая температура Т=405К
-Критическое давление Р= 11МПа
При критических Т и Р свойства жидкости и газа совпадают.
-Температура кипения Т=240К
-Температура 3-й точки Т=195К
В 3-й точке одновременно существуют три фазы: твердая, жидкая и газообразная.
-Давление в 3-й точке Р=6000 Па
-Удельная теплота парообразования 1372 КДж/кг. Свойства растворов бромистого лития.
Следует обратить внимание на то, что литий по положению в электрохимическом ряду самый активный металл (φ0 = –3,045 В), хотя по положению в периодической таблице он, в сравнении с остальными щелочными металлами, является самым слабым восстановителем. Это является следствием того, что положение металла в электрохимическом ряду определяется суммой трех величин:
1) энергии разрушения кристаллической решетки;
2) энергии ионизации металла;
3) энергии гидратации образовавшегося иона.
Энергии разрушения кристаллической решетки для данных металлов примерно одинаковы. Энергия ионизации атома лития в подгруппе самая высокая (Е = 5,39 эВ), но энергия гидратации иона лития, благодаря малому радиусу, аномально высокая. По сумме данных трех величин литий в водном растворе электрохимически самый активный металл.
Литий бром обладает очень высокой энергией гидратации, т.е эта энергия которая выделяется при взаимодействии.
-Q + LiBr + xH2O à LiBr * nH2O+Br * (x-n)*H2O +Q
В этом соединении самой высокой энергией гидратации обладает ион лития (Li+)
Энергия гидратации складывается из трех величин:
1. Разрушение кристаллической решетки LiBr ( -Q)
2. Диффузия ионов лития по всему объему раствора (-Q)
3. Гидратация (+Q)
Преимущество литийбромидных машин в том, что они могут использовать вторичные источники. А основная проблема – коррозия.
3 Растворы
3.1 Общие свойства растворов
3.1.1 Классификация систем, состоящих из двух и более веществ
Системы, состоящие из двух и более веществ, в зависимости от размеров частиц можно разделить на дисперсные системы(10–3 ÷ 10–5 см), коллоидные растворы(10–5 ÷ 10–7 см) и истинные растворы(менее 10–7 см).
Дисперсная система – это система из двух или более веществ, в
которой одно или несколько веществ измельчено и равномерно распределено в другом. Дисперсная система состоит из совокупности мелких частиц –дисперсная фаза и окружающего их вещества – дисперсионная среда. Классификация дисперсных систем по агрегатному состоянию приведена в
таблице 3.1.
Таблица 3.1 – Классификация дисперсных систем
| Дисперсионная среда | Дисперсная фаза | ||
| Г | Ж | Т | |
| Г | – | аэрозоли туман, облака | аэрозоли дым, пыль |
| Ж | пены мыльная пена, пивная пена | эмульсии молоко, масло сливочное | взвеси (суспензии) краски, лаки |
| Т | твердые пены пенопласт, пемза и т.д. | твердые эмульсии желеорабразные студни | твердые суспензии, сплавы |
Обозначения: Г – газ, Ж – жидкость, Т – твердое вещество.
Важной характеристикой дисперсных систем является степень дисперсности (D) или степень раздробленности. С увеличением степени раздробленности резко возрастает площадь поверхности дисперсной фазы, что приводит к увеличению поверхностных явлений на границе раздела фаз.
Дисперсные системы термодинамически неустойчивы и с течением времени разделяются. Различают кинетическую (за счет действия силы тяжести) и агрегативную (за счет укрупнения размеров частиц) устойчивости.
Коллоидный раствор – это система, характеризующаяся такой степенью раздробленности компонентов, при которой броуновское движение препятствует осаждению частиц.
Коллоиды по внешнему виду напоминают истинные растворы. Однако при прохождении светового луча через прозрачный коллоидный раствор луч становится видимым сбоку на темном фоне. Этот оптический эффект называется конусом Тиндаля.
Коллоиды находятся в метастабильном состоянии и достаточно небольшого внешнего воздействия, чтобы началось разделение компонентов коллоидного раствора.
Истинный раствор – это система, в которой растворённое вещество и растворитель измельчены до атомного или молекулярного уровня и равномерно распределены по всему объему раствора. Истинные растворы – термодинамически устойчивые системы. В последующем вместо названия истинный раствор будет применяться термин «раствор».
Раствор – это гомогенная однородная система, состоящая из двух или более компонентов.
Растворы имеют большое практическое значение, в них протекают многие химические реакции. В большинстве пищевых технологий применяются растворы. Последующий материал посвящен изучению свойств водных растворов.
3.1.2 Способы выражения состава растворов
Приведем наиболее часто применяемые на практике концентрации растворов.
Массовая доля (ω) – отношение массы растворенного вещества к массе раствора:
ω(x) = 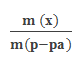 . .
| (3.1) |
Массовая доля выражается в долях от единицы или в процентах (в долях от ста). Процентная концентрация показывает, сколько граммов растворённого вещества содержится в 100 г раствора. Например: ω(Н2SО4) = 0,3 или 30 % Н2SО4, т.е. в 100 г раствора содержится 30 г Н2SО4.
Мольная доля (N) – отношение количества молей растворенного вещества к общему числу молей раствора. В случае двухкомпонентного раствора формула имеет вид:
N(х)  . .
| (3.2) |
Мольная доля показывает, сколько молей растворенного вещества приходится на один моль раствора. Например,
N(Н2SО4) = 0,2, т.е. на один моль раствора приходится 0,2 моль Н2SО4.
Массовая и мольная доли являются безразмерными величинами.
Молярная концентрация (С) – отношение количества молей растворенного вещества к объему раствора:
С(х) 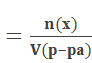 . .
| (3.3) |
Сокращенное обозначение молярной концентрации – М. На практике молярную концентрацию выражают обычно в моль/л. Например:
С(Н2SО3) = 0,2 моль/л или 0,2 М Н2SО3, т.е. в одном литре раствора содержится 0,2 моль Н2SО3. В случае равновесной молярной концентрации будет применяться следующая запись: [Н2SО3].
С(fэкв.(х)х)  . .
| (3.4) |
Молярная концентрация эквивалента С(fэкв.(х)х) или нормальная концентрация (н) – отношение количества моль эквивалентов растворенного вещества к объему раствора:
Например, С(1/2 Н2SО4 ) = 0,4 моль экв./л или 0,4 н Н2SО4, т.е. в одном литре раствора содержится 0,4 моль эквивалента Н2SО4.
Моляльная концентрация (Сm) – отношение количества молей растворенного вещества к 1 кг растворителя:
Cm(х)  . .
| (3.5) |
Например, Сm(Н2SО4) = 0,3 моль/кг, т.е. на 1 кг растворителя приходится 0,3 моль Н2SО4.
Массовые концентрации (массовая доля, моляльная) не зависят от температуры. В случае применения в формуле объема концентрация раствора будет зависеть от температуры, поэтому её относят к определенной температуре.
Коррозия металлов
Коррозия – процесс окисления металла под воздействием окружающей среды. Наибольший вред от коррозии приходится на долю основного конструкционного металла – железа. Безвозвратные потери металлов от коррозии составляют примерно 10÷15 % мировой продукции стали. Но еще больший вред связан не с потерей металла, а с порчей изделий. Таким образом, борьба с коррозией является важной народнохозяйственной задачей.
9.1 Виды и типы коррозии
По характеру разрушения металла применяется следующая классификация видов коррозии:
1) равномерная; 2) пятнами; 3) точечная;
4) вглубь металла (язвенная); 5) растрескивающаяся;
6) селективная – разрушается отдельный вид кристаллической структуры металла;
7) межкристаллитная – разрушаются связи между отдельными кристаллами. Является наиболее опасным видом коррозии, так как в результате данной коррозии резко ухудшаются механические характеристики металла, но внешне это почти не обнаруживается.
В зависимости от механизма окисления металла различают следующие типы коррозии:
1) химическая; 2) гальванокоррозия; 3) электрокоррозия.
Химическая коррозия протекает в жидкостях, не проводящих электрический ток, и в газовых средах.
Газовая коррозия протекает при высоких температурах. Среди газовых сред самые распространенные O2, SO2, Cl2, H2O, H2S, оксиды азота и другие.
Данный тип коррозии можно описать посредством следующих реакций:
4Fe + 3O2 ® 2Fe2O3, Fe + H2O ® FeO + H2, Fe + CO2 ® FeO + CO и т.д.
Для ряда металлов, например, алюминия, свинца и др., при окислении кислородом поверхности образуется прочная оксидная пленка, препятствующая дальнейшему окислению металла, в результате этого металл становится «пассивным», т.е. устойчивым в данной среде.
Гальванокоррозия – это коррозия металлов по типу гальванического элемента. Протекает тогда, когда создаются условия для работы гальванического элемента. Гальванокоррозию можно разделить на микрогальванокоррозию и контактную коррозию.
Микрогальванокоррозия – протекает в деталях, включающих кристаллы металлов с различной электрохимической активностью. В реальных условиях химически чистые металлы применяются редко, они обычно включают примеси, естественные или искусственно введенные (например, в сплавах). При контакте с электролитом, например, влагой, между кристаллами различных металлов возникает разность потенциалов и, если в растворе имеется потенциальный окислитель, то протекает электрохимический процесс, при котором окисляется металл с меньшим электродным потенциалом.
Контактная коррозия – протекает в конструкции, включающей находящиеся в контакте металлы с различной электрохимической активностью и находящейся в среде электролита.
Рассмотрим различные варианты гальванокоррозии металлов. Наиболее часто на практике встречается гальванокоррозия чугуна в нейтральной и кислой средах, контактная коррозия железа, а также коррозия вследствие неравномерной аэрации. Составим схемы и опишем работу соответствующих гальванических элементов.
1) Гальванокоррозия чугуна в нейтральной среде.
Схема соответствующего гальванического элемента имеет вид:
(A)Fe | О2, Н2О | С(К).
В данной гальванопаре железо имеет меньшее значение φ, поэтому будет анодом.
Составим уравнения анодного и катодного процессов:
A) Fe – 2е = Fe2+,
К) О2 + 2Н2О + 4е = 4ОН–.
Образующиеся ионы обеспечивают проводимость во внутренней цепи по реакции Fe2+ + 2ОН– = Fe(OH)2.
В присутствии кислорода протекает следующие вторичные реакции:
4Fe(ОH)2 + О2 + 2Н2О = 4Fe(OH)3,
Fe(OH)3 = FeOOH (ржавчина) + Н2О.
2) Гальванокоррозия чугуна в кислой среде.
(A) Fe | НС1, О2, Н2О | С (К).
A) Fe – 2e = Fe2+,
К) 2Н+ + 2е = Н2 .
Fe2+ + 2Сl– = FeCl2,
FeCl2 + 2Н2О = Fe(OH)2 + 2НС1 (гидролиз),
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3 , Fe(OH)3 = FeOOH + Н2О.
3) Контактная коррозия железа и меди в нейтральной среде.
(A)Fe | О2, Н2О | Сu(К).
В данной гальванопаре железо будет анодом.
A) Fe – 2е = Fe2+, К) О2 + 2Н2О + 4е = 4ОН–.
Fe2+ + 2ОН– = Fe(OH)2. 4Fe(ОH)2 + О2 + 2Н2О = 4Fe(OH)3,
Fe(OH)3 = FeOOH (ржавчина) + Н2О.
4) Коррозия при неравномерной аэрации возникает в том случае, когда
деталь находится в растворе электролита, но доступ кислорода к различным
частям металла неодинаков. Коррозии подвергается та часть детали, доступ кислорода к которой минимален. Химизм данной коррозии согласуется с приведенными выше схемами.
Из приведенных примеров видно, что исходным продуктом коррозии является Fe2+ , которое под действием кислорода воздуха далее окисляется до Fe3+ (Fe(OH)3). Гидроксид железа(III) термически нестоек и поэтому распадается на оксидгидроксид железа(III) и воду.
Электрокоррозия возникает, когда металлическая конструкция находится в среде электролита и расположена вблизи источника электрической энергии. Часть электрического тока вследствие утечки попадает на металлическую конструкцию и приводит к электрохимическому разрушению конструкции по типу электролиза.
9.2 Способы защиты металлов от коррозии
Так как наибольший ущерб наносит гальванокоррозия, для предотвращения её надо устранить хотя бы одно из условий, необходимых для работы потенциального гальванического элемента: наличие электродов с различными значениями электродного потенциала, электролита и потенциального окислителя.
Рассмотрим различные методы защиты металлов от коррозии.
9.2.1 Изолирование металлов от внешней среды
Самый простой способ – защищаемый металл изолируют от окружающей среды с помощью покрытий: лаками, красками, эмалями, пластиками, другими металлами или другими материалами. Изоляция металлов от внешней среды также достигается при оксидировании, фосфатировании, борировании, цементации, азотировании и других видах обработки поверхности металлов. Главные требования к покрытиям – необходимые механические характеристики и прочное сцепление с поверхностью металла (адгезия).
Остановимся на особенностях металлических покрытий. В случае покрытия одного металла другим контактировать с окружающей средой и окисляться будет уже металл покрытия. На практике в качестве покрытия используются Cr, Ni, Sn, Zn и другие металлы. Но в случае, если покрытие частично разрушится и изделие находится в среде электролита, создаются условия для протекания контактной гальванокоррозии. В зависимости от сравнительной активности контактирующих металлов металлическое покрытие может быть анодным или катодным. Рассмотрим данный вопрос на примере гальванокоррозии оцинкованного и луженого железа с частично разрушенными покрытиями:
1) Гальванокоррозия оцинкованного железа в нейтральной среде.
Схема гальванического элемента:
(A) Zn | О2, Н2О | Fe (К).
В данной гальванопаре цинк имеет меньшее значение φ, поэтому будет являться анодом.
Реакции на электродах:
A) Zn – 2е = Zn2+, К) О2 + 2Н2О + 4е = 4ОН–.
Реакция в растворе электролита
Zn2+ + 2ОН– =Zn(OH)2.
Из данной схемы видно, что в случае частичного разрушения анодного покрытия коррозии подвергается металл покрытия, при этом металл покрытия будет выполнять защитную функцию по типу протекторной защиты.
2) Гальванокоррозия луженого железа в кислой среде.
Схема гальванического элемента:
(A) Fe | НС1, О2, Н2О | Sn (К).
В данной гальванопаре олово имеет большее значение φ, поэтому будет являться катодом.
Реакции на электродах и в растворе электролита:
A) Fe – 2e = Fe2+, К) 2Н+ + 2е = Н2.
Fe2+ + 2Сl– = FeCl2,
FeCl2 + 2Н2О = Fe(OH)2 + 2НС1 (гидролиз),
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3, Fe(OH)3 = FeOOH + Н2О.
Покрытие менее активным металлом является опасным покрытием, так как после его частичного разрушения возникает гальванопара, которая приводит к усилению коррозии защищаемого металла.
9.2.2 Изменение состава коррозионной среды
Изменить состав коррозионной среды возможно, если деталь находится в ограниченной небольшими размерами замкнутой системе.
Из ранее приведенных схем коррозии следует, что функцию окислителя могут выполнять кислород, вода и кислоты, а восстановителя – железо. Сравним окислительно-восстановительные потенциалы данных систем:
O2 + 4H+ + 4е = 2H2O φ0 = + 1,23 В,
O2 + 2H2O + 4е = 4ОН– φ0 = + 0,40 В,
2Н2О + 2е = H2 + 2OH– φ0 = – 0,83 В,
Fe – 2е = Fe2+ φ0 = – 0,44 В.
Из приведенных значений следует, что в отсутствие кислорода и кислот окисление железа происходить не будет.
В среде, контактирующей с металлической конструкцией, должен отсутствовать электролит и окислитель с более высоким, чем у металла, окислительно-восстановительным потенциалом. Из внешней среды должны быть удалены активаторы коррозии Cl–, Br– и др. и в случае необходимости добавлены вещества, резко замедляющие коррозию – ингибиторы.
Механизм действия ингибиторов пока не исследован полностью. Поэтому подбор ингибиторов проводится в основном экспериментальным путем. В частности, было установлено, что ингибиторами коррозии железа в кислой среде является органические амины. В литературе имеется большой справочный материал по применению ингибиторов.