 |
|
Молекулярно–кинетическая теория
Молекулярно–кинетическая теория газов объяснила физический смысл таких важных понятий как теплота, температура, давление, вязкость, теплоемкость, теплопроводность и других понятий.
2.1 Теплота – это кинетическая энергия движения атомов и молекул.
Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это движение воспринимается как тепло. Одним из первых непосредственных доказательств наличия теплового хаотического движения частиц в веществе явилось открытие броуновского движения. Оно заключается в том, что весьма малые (видимые только в микроскоп) взвешенные в жидкости частицы всегда находятся в состоянии непрерывного хаотического движения, которое является следствием соударения данных частиц с молекулами жидкости. Частицы более нагретого вещества движутся быстрее, чем холодного. Средняя скорость молекул в газе даже при умеренных температурах оказывается очень большой. Так, для молекул водорода (H2) при комнатной температуре (T = 293K) эта скорость равна около 1900 м/c, для молекул азота – порядка 500 м/c. Благодаря высоким скоростям в системе достаточно быстро устанавливается состояние теплового равновесия: давление и температура во всех местах внутри сосуда становятся одинаковыми. Но даже в состояние теплового равновесия молекулы газа движутся беспорядочно, сталкиваясь между собой и со стенкой сосуда, беспрерывно меняя свою скорость. Это означает, что в каждый момент времени в газе есть молекулы, которые имеют самые различные скорости, но при неизменной температуре распределения молекул по скоростям во всех частях сосуда остается постоянным. В графическом виде распределение частиц по скоростям (энергиям) для двух различных температур (T2 > T1) приведено на рисунке 3.

Рисунок 3. Распределение частиц по скоростям
Площади под каждой кривой показывают общее число частиц, которое одинаково при различных температурах. Но при повышении температуры увеличивается доля частиц с более высокой скоростью (энергией).
2.2 Температура – это количественный показатель энергетического состояния системы или усредненной кинетической энергии движения частиц вещества. Температура измеряется в градусах Цельсия (t °C) или в градусах Кельвина (T K) – абсолютная температура. Они связаны следующим соотношением:
T K = 273,15 + t °C.
Абсолютная температура идеального газа является мерой кинетической энергии его молекул и прямо пропорциональна ей. Это обозначает, что газы, находящиеся при одинаковой температуре, обладают одинаковой кинетической энергией молекул.
2.3 Давление (Р) – это сила, оказываемая веществом на стенки сосуда.
Давление является результатом многочисленных соударений движущихся молекул со стенкой сосуда, в результате которых они передают стенке энергию своего движения.
Если в сосуде имеется смесь разных газов, то давление, передаваемое стенке молекулами одного вида, не зависит от наличия в газе молекул других видов. Отсюда следует, что давление смеси идеальных газов равно сумме парциальных давлений, которые создавал бы каждый газ в отдельности, если бы занимал весь объем сосуда.
Давление в системе СИ измеряется в паскалях (Па), Существуют внесистемные единицы измерения давления: атмосфера (атм), миллиметр ртутного столба (мм рт. ст.), бар (бар). Единицы измерения давления связаны между собой следующим соотношением:
101325 Па = 1 атм = 760 мм рт. ст.; 1 бар = 100 КПа.
2.4 Теплоёмкость (С) – это отношение количества теплоты, поглощенной системой, к вызванному этим повышению температуры (  ). При этом, в данном температурном интервале не должны протекать реакции и фазовые переходы.
). При этом, в данном температурном интервале не должны протекать реакции и фазовые переходы.
С =  . Отсюда: ΔQ = C·ΔТ.
. Отсюда: ΔQ = C·ΔТ.
Количество теплоты измеряют в джоулях (Дж) и калориях (кал). 1 Дж равен энергии которую необходимо затратить на подъем тела массой 1 кг на высоту 1 м, а 1 кал это энергия необходимая для нагрева 1 г воды на 1 градус в интервале температур 19,5 ÷ 20,5 0С. При этом 1 кал= 4,1840 Дж.
Различают теплоемкости:
1) истинную – отнесенную к бесконечно малому изменению Т,
2) мольную – отнесенную к 1моль вещества,
3) удельную – отнесенную к 1г (1кг) вещества.
Для газов различают теплоемкости: изохорную (Cv), определяемую при v=const, и изобарную (Cp), определяемую при p=const. Данные теплоемкости связаны между собой следующим соотношением Cp - Cv = R. Следует отметить, что при 0 К Cp = Cv.
В таблице … приведены значения Cp и Cv.(кал/0С·моль) некоторых газов при 15 0С.
Таблица… Значения Cp и Cv.(кал/0С·моль) некоторых газов при 15 0С.
| Газ | Cp | Cv | Газ | Cp | Cv |
| Не | 4,99 | 3,00 | Cl2 | 8,14 | 6,00 |
| Н2 | 6,82 | 1,99 | CО2 | 8,75 | 6,71 |
| СО | 6,93 | 4,93 | С2Н2 | 9,96 | 7,91 |
| N2 | 6,93 | 4,94 | С6Н6 | 25,4 | 23,1 |
Из приведенной таблицы видно, что самая низкая теплоемкость у одноатомного газа (Не), так как энергия системы определяется только поступательным движением атомов. При увеличении атомов в молекуле теплоемкость возрастает, что связано с появлением дополнительных форм движения – колебанием и вращением атомов в молекуле относительно друг друга. Следует отметить, что эти составляющие проявляются при повышенных температурах.
Зависимость теплоёмкости от температуры не носит линейный характер. Как видно, из рисунке 4, графическая зависимость для меди имеет сложный характер.

Рисунок 4. Зависимость теплоемкости меди от температуры
2.5 Вязкость ─ это сопротивление передвижению одного слоя вещества относительно другого. Для газов вязкость имеет малые значения, так как в газообразном состоянии частицы находятся на значительном удалении друг от друга, поэтому вероятность их столкновения в пространстве и соответственно межмолекулярного взаимодействия мала. Вязкость иногда называют внутренним трением. Данные по значениям вязкости имеют большой практический интерес, так как количество энергии, необходимое для перемещения жидкости по трубопроводам, находится в прямо пропорциональной зависимости от вязкости жидкости.
Количественно вязкость (η) равна силе на единицу поверхности соприкасающихся фаз, которая достаточна для поддержания определенной скорости перемещения одного слоя относительно другого. Вязкость выражается в пуазах (1П = 1 г∕см·с). Величина обратная вязкости ( 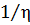 ) называется текучестью.
) называется текучестью.
При повышении температуры вязкость понижается, так как при расширении жидкости увеличивается расстояние между молекулами и соответственно ослабляется взаимное притяжение между ними. В таблице 1 показана зависимость вязкости некоторых веществ от температуры.
| Жидкость | Вязкость, сП | ||
| 0 0С | 20 0С | 50 0С | |
| Вода | 1,789 | 1,005 | 0,550 |
| Этанол | 1,78 | 1,19 | 0,701 |
| Глицерин | ─ |
В первом приближении зависимость вязкости от температуры пропорциональна  .
.
Измерение вязкости веществ в жидком состоянии можно проводить на капиллярном вискозиметре.
Для исследуемого образца жидкости определяется время истечения определенного объема жидкости из измерительного резервуара. Полученное значение времени подставляется в формулу
V =  ·Т·К,
·Т·К,
V – кинематическая вязкость жидкости в мм2/с;
g – ускорение свободного падения в месте измерения в м/с2;
Т – время истечения жидкости в секундах;
К – постоянная вискозиметра в мм2/с2.
2.6 Теплопроводность –это способность материала проводить тепло.
Приток тепла из окружающей среды возможен посредством теплообмена, конвекции и излучения. Суммарное влияние этих факторов характеризует теплопроводность материала. Теплопроводность (лямбда) равна количеству тепла, которое пройдет через слой материала с площадью 1 м2 и толщиной 1м за 1 секунду при градиенте температур 1 К. (в интервале температур ?). Размерность теплопроводности Вт/(м·К).
Теплообмен (или теплоперенос) происходит посредством перехода тепла через материал. Теплоперенос газа определяется длиной свободного пробега молекул газа между соударениями, достигая практически нуля при абсолютном вакууме, для снижения лучеиспускания.
Конвекция осуществляется за счет перемешивания среды через которую происходит теплообмен. При повышении температуры конвективный теплообмен возрастает.
Лучеиспускание – это электромагнитное (hν) излучение материала. Вещество состоит из атомов, которые в свою очередь состоят из положительно заряженных ядер и электронов. Переходы электронов с более низкого на более высокий энергетический уровень сопровождаются поглощением электромагнитных волн с определенными, для каждого материала, значениями частот. Например, окраска вещества является следствием поглощения электромагнитных волн в видимой части спектра. В свою очередь обратный процесс сопровождается излучением определенных значений электромагнитных волн, такой спектр называют эммисионным. Не только электронные переходы, но и другие процессы в атомах и молекулах сопровождаются электромагнитным излучением. Электромагнитные волны по увеличению энергии излучения располагаются в следующий ряд: радиоволны, инфракрасное излучение, видимая часть спектра, ультрафиолетовое и рентгеновское излучение. Излучение пропорционально четвертой степени абсолютной температуры, так как с повышением температуры возрастает интенсивность и доля излучения с более высокой энергией. Но опытные данные показывают, что общая теплопроводность материалов находится в линейной зависимости от температуры
φ = φ0(1 + bt),
где φ0 – теплопроводность материала при 0 оС,
b – температурный коэффициент теплопроводности материала,
t – температура.
Лучеиспускание уменьшается посредством рассеивания и отражения лучей экранами из материалов с высокой отражательной способностью.