 |
|
Изомерия и номенклатура
Кафедра органической, физической и коллоидной химии
Дистанционное
обучение
Хим.орг.-1.11.2701 зчн.плн. Хим.орг.-1.11.2703 зчн.плн. Хим.орг.-1.11.2704 зчн.плн. Хим.орг.-1.11.2705 зчн.плн.
Хим.орг.-1.11.2701 зчн.скр. Хим.орг.-1.11.2703 зчн.скр. Хим.орг.-1.11.2704 зчн.скр. Хим.орг.-1.11.2705 зчн.скр.
Хим.орг.-1.11.2701 очн.плн. Хим.орг.-1.11.2703 очн.плн. Хим.орг.-1.11.2704 очн.плн. Хим.орг.-1.11.2705 очн.плн.
Хим.орг.-1.11.2701 вчр.плн. Хим.орг.-1.11.2703 вчр.плн. Хим.орг.-1.11.2704 вчр.плн. Хим.орг.-1.11.2705 вчр.плн.
Хим.орг.-1.11.2701 вчр.скр. Хим.орг.-1.11.2703 вчр.скр. Хим.орг.-1.11.2704 вчр.скр. Хим.орг.-1.11.2705 вчр.скр.
Хим.орг.-1.11.2707 зчн.плн. Хим.орг.-1.11.2708 зчн.плн. Хим.орг.-1.11.27010 зчн.плн. Хим.орг.-1.11.27012 зчн.плн.
Хим.орг.-1.11.2707 зчн.скр. Хим.орг.-1.11.2708 зчн.скр. Хим.орг.-1.11.27010 зчн.скр. Хим.орг.-1.11.27012 зчн.скр.
Хим.орг.-1.11.2707 очн.плн. Хим.орг.-1.11.2708 очн.плн. Хим.орг.-1.11.27010 очн.плн. Хим.орг.-1.11.27012 очн.плн.
Хим.орг.-1.11.2707 вчр.плн. Хим.орг.-1.11.2708 вчр.плн. Хим.орг.-1.11.27010 вчр.плн. Хим.орг.-1.11.27012 вчр.плн.
Хим.орг.-1.11.2707 вчр.скр. Хим.орг.-1.11.2708 вчр.скр. Хим.орг.-1.11.27010 вчр.скр. Хим.орг.-1.11.27012 вчр.скр.
Ю.И.Блохин
Галогенопроизводные
Углеводородов
Учебно-практическое пособие
для студентов технологических специальностей всех форм обучения

Москва – 2007
УДК 547
Ó Автор: Блохин Ю.И.
Галогенопроизводные углеводородов. Учебно-практическое пособие – М., МГУТУ, 2007
В учебно-практическом пособии изложены основные понятия, классификация, изомерия и номенклатура галогенопроизводных углеводородов. Рассматриваются также основные методы получения галогенопроизводных, их физические и химические свойства. В разделах «методы получения» и «химические свойства» для главных реакций приведены механизмы химических процессов, обсуждаются их условия, что необходимо для освоения студентами данного учебного материала. Для подтверждения полученных знаний приводятся вопросы для контроля.
Учебно - практическое пособие составлено в соответствии с учебными планами для студентов технологических специальностей, предназначен для всех форм обучения (очной, полной и сокращённой заочной, вечерней).
Автор: Блохин Юрий Иванович, д.х.н., профессор.
Рецензенты: Кузнецов Анатолий Иванович, д.х.н., профессор (кафедра
органической химии Московской государственной академии
тонкой химической технологии им М.В.Ломоносова)
Панкратов Владимир Алексеевич, д.х.н., профессор (кафедра органической химии Московского государственного университета прикладной биотехнологии).
Редактор: Свешникова Н.И.
Ó Московский государственный университет технологий и управления, 2007
109004, Москва, Земляной вал, 73
Оглавление
Введение………………………………………………………………………4
1. Классификация галогенопроизводных ……………………………….......5
2. Изомерия и номенклатура ………………………………………………….6
3. Методы получения …………………………………………………………..8
1. Замещение атомов водорода в углеводородах на галоген ………………8
2. Присоединение галогенов к ненасыщенным углеводородам ………….11
3. Присоединение галогеноводородов к ненасыщенным углеводородам.11
4. Получение галогенопроизводных из спиртов …………………………...12
4. Физические свойства ……………………………………………………….13
5. Химические свойства ………………………………………………………13
1. Реакции нуклеофильного замещения (SN1и SN2) …………………………14
2. Реакции β-элиминирования (Е1 и Е2). Отщепление галогеноводородов..17
3. Замещение атомов галогена водородом ………………………………….18
4. Взаимодействие с солями галогеноводородной кислоты ……………….19
5. Реакция Вюрца ……………………………………………………………..19
6. Получение магнийорганических соединений ……………………………19
7. Реакции с алкоголятами …………………………………………………...19
8. Взаимодействие с аммиаком и аминами …………………………………19
9. Взаимодействие с солями синильной кислоты …………………………..19
10. Взаимодействие с солями органических кислот ………………………..20
11. Реакции с нитритом серебра ……………………………………………...20
12. Взаимодействие с металлами …………………………………………….20
6. Отдельные представители …………………………………………………21
7. Вопросы для контроля ……………………………………………………..22
8. Литература …………………………………………………………………..23
Введение
Органическая химия является одной из наиболее развивающихся химических дисциплин, которая оказывает влияние на все стороны жизни человека. Достижения органической химии в последнее время существенно изменили многие области, в которых она применяется. В этом наглядно проявляется естественная и объективная связь органической химии со смежными дисциплинами, например, медициной, биологией, биохимией, технологией создания новых материалов, продуктов питания и защиты окружающей среды. В этой связи студентам необходимы знания по органической химии, которые они получают при последовательном изучении разделов дисциплины «Органическая химия».
Целью данного учебно-практического пособия является ознакомление студентов в рамках рабочей программы по органической химии с интересным в плане синтеза и реакционной способности классом органических соединений – галогенопроизводными углеводородов, имеющих широкое применение в разных областях промышленности, медицине, сельском хозяйстве и в быту.
1. Классификация галогенопроизводных
Галогенопроизводными называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на атомы галогена (F, Cl, Br, I). В зависимости от количества атомов галогена в молекуле галогенопроизводные углеводородов подразделяются на моногалогенопроизводные, (например СН3Сl – хлористый метил), дигалогенопроизводные (СН2Сl2 – хлористый метилен) и т.д. Соединения, содержащие два и более атома галогена, называются полигалогенопроизводными.
Моногалогенопроизводные углеводоров в зависимости от характера углеводородного остатка различают:
а) насыщенные СН3-СН2Cl хлористый этил
(предельные) (этилхлорид)
б) ненасыщенные СН2 = СН-СН2Вr бромистый аллил
(непредельные) (аллилбромид)
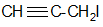 - иодистый пропаргил
- иодистый пропаргил
(пропаргилиодид)
в) ароматические 
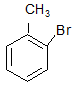
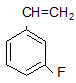
(арилгалогениды) хлорбензол орто-бромтолуол мета-фторстирол
В ароматических галогенопроизводных атомы галогена могут находится также и в боковой цепи:
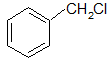
бензилхлорид
Дигалогенопроизводные в зависимости от взаимного расположения атомов галогена в молекуле различают геминальные (сокращенно гем-дигалогениды) и вицинальные (сокращённо виц-галогениды).
В геминальных дигалогенопроизводных оба атома галогена связаны с одним и тем же атомом углерода, а в вицинальных – атомы галогена находятся у соседних атомов углерода:
 Cl CH3 - CH – CH2
Cl CH3 - CH – CH2


 CH3 – CH
CH3 – CH
Cl Br Br
гем-дихлорид виц-дибромид
Кроме того, моногалогенопроизводные предельных углеводородов в зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связан галоген, подразделяются на первичные вторичные и третичные, например
 CH3
CH3
СН3-СН2-СН2-СН2-Сl СН3-СН-СН2-СН3 СН3-С-СН3

 первичный хлористый
первичный хлористый
бутил Сl Br
вторичный хлористый третичный бромистый
бутил изобутил
Изомерия и номенклатура
Изомерия галогенопроизводных связана с особенностями строения углеродного скелета (линейная или разветвленная структура), положением атомов галогена в углеродной цепи:
1. СН3-СН2-СН2-СН2-Br 2. СН3-СН-СН2-СН3

 первичный бромистый
первичный бромистый
бутил Br
(линейная структура вторичный бромистый
углеродного скелета, бутил
атом галогена у (линейная структура
концевого атома углеродного скелета,
углерода) атом галогена у среднего
атома углерода)
3. СН3-СН-СН2-Br СН3
 |  |
СН3 4. СН3-С-СН3
 первичный бромистый
первичный бромистый
изобутил Сl
(разветвленная структура третичный хлористый
углеродного скелета, атом изобутил
галогена у концевого атома (разветвленная структура
углерода) углеродного скелета,
атом галогена у среднего
атома углерода)
и различным расположением атомов и групп в пространстве (цис-, транс-изомерия; оптическая изомерия):
СН3 СН3
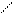


 СН3 Н С = С
СН3 Н С = С



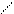
 С = С
С = С
Сl CH3 Сl H
транс-форма цис-форма
При названии галогенопроизводных углеводородов используют: тривиальную, рациональную и систематическую (ИЮПАК) номенклатуры.
Тривиальная номенклатура в галогенопроизводных применяется в отдельных случаях: хлороформ СНCl3, йодоформ СНI3.
По рациональной номенклатуре название галогенопроизводных образуется из названия углеводородного радикала и галогена, положение последнего при необходимости указывается:
С2Н5Сl СН3-СН-СН2-СН3 СН2= СН-Br С6Н5СН2Br
 хлористый этил бромистый бромистый (этилхлорид) Br винил бензил
хлористый этил бромистый бромистый (этилхлорид) Br винил бензил
бромистый втор-бутил (винилбромид) (бензилбромид)
(втор-бутилбромид)
Если в молекуле галогенопроизводного находится два атома галогена, то углеводородный радикал называется в зависимости от положения этих атомов в углеродной цепи. Так, при расположении атомов галогена у соседних атомов углерода, к названию радикала прибавляется суффикс – ен (в этом случае двухвалентный радикал образуется отнятием двух атомов водорода от двух соседних атомов углерода):
СН2Cl-CH2Cl СН3-CHCl-CH2Cl
хлористый этилен хлористый пропилен
(этиленхлорид) (пропиленхлорид)
Если оба атома галогена находятся при одном и том же концевом атоме углерода, то к названию радикала добавляется суффикс - иден (в данном случае двухвалентный радикал получается отнятием двух атомов водорода от одного крайнего атома углерода):
СН3-CHCl2 СН3-CH2-CHI2
хлористый этилиден йодистый пропилиден
(этилиденхлорид) (пропилиден йодид)
Углеводородные радикалы дигалогенопроизводных, в которых два атома галогена находятся у концевых атомов углерода, содержат ряд метиленовых (-СН2-) групп, в зависимости от количества которых и образуются их названия:
СН2Cl-CH2-CH2Cl СН2Br-CH2-CH2-CH2Br
хлористый триметилен бромистый тетраметилен
(триметиленхлорид) (тетраметиленбромид)
Галогенопроизводные, у которых все имевшиеся в молекуле атомы водорода замещены на галоген, называются пергалогенопроизводными:
СF3-CF3 СF2=CF2
перфторэтан перфторэтилен
По систематической номенклатуре (ИЮПАК) при названии галогенопроизводных выбирается наиболее длинная цепь углеродных атомов, включающая при наличии краткую связь (главная цепь). Атомы углерода этой цепи нумеруются цифрами. Нумерация начинается с того конца, к которому ближе расположен атом галогена. Название галогеносодержащих соединений производится от соответствующего алкана, впереди которого ставится название галогена и цифра, указывающая при каком атоме углерода от начала цепи находится галоген (аналогично указываются и другие заместители в молекуле):
3 4
 СН3Сl 1 2 3 1 2 СН2-СН3
СН3Сl 1 2 3 1 2 СН2-СН3
 хлорметан СН3-СНСl-СН3 Cl H2C-C
хлорметан СН3-СНСl-СН3 Cl H2C-C
2-хлорпропан СН3
1-хлор-2-метилбутан
Если в галогеносодержащем углеводороде имеется атом галогена и кратная связь, то начало нумерации определяет кратная связь:
1 2 3 4 1 2 3 4 5
СН2=СН-СН2-СН2Br СН3-С=С-CH2-CH2Br

 4-бром-1-бутен
4-бром-1-бутен
Н3C Cl
5-бром-2-метил-3-хлор-2-пентен
Ди- и полигалогенопроизводные называются по тем же правилам, что и моногалогенопроизводные:
СН2Cl-CH2Cl CH3-CHCl2
1,2-дихлорэтан 1,1-дихлорэтан
Методы получения
1. Замещение атомов водорода в углеводородах на галоген.
Таким образом галогенируют алканы, циклоалканы, бензол и его гомологи, алкены.
В частности, хлорирование метана широко применяется в промышленности. Реакция идет на свету (под действием УФ-облучения; hv) и в темноте (при нагревании 250-4000С или в присутствии катализаторов - хлориды меди, сурьмы, олова или йод). При этом газообразный хлор последовательно замещает в молекуле метана все четыре атома водорода с образованием соответствующих галогенопроизводных:
CH4 + Cl2 → CH3Cl + HCl
метан хлорметан
(хлористый метил)
CH3Cl + Cl2 → CH2Cl2 + HCl
дихлорметан
(хлористый метилен)
CH2Cl2 + Cl2 → CHCl3 + HCl
трихлорметан
(треххлористый углерод, хлороформ)
CHCl3 + Cl2 → CНCl4 + HCl
тетрахлорметан
(четыреххлористый углерод)
В реакциях с алканами галогены располагаются по своей реакционной способности в следующем порядке:
F > Cl > Br > I
При этом фтор реагирует с алканами очень активно и реакции обычно сопровождаются взрывами, а йод вообще не взаимодействует, так как образующийся HI является очень сильным восстановителем и восстанавливает образовавшееся иодпроизводное снова до углеводорода.
Галогенирование алканов как под действием света (реакция металепсии),так и при высоких температурах протекает по радикально-цепному механизму и является реакцией радикального замещения (SR):
на стадии I при УФ-облучении (фотохимическое галогенирование) или повышенных температурах (термическое галогенирование) молекулы галогена распадаются на радикалы:
hν; tºC
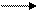 I. Cl : Cl Cl • + Cl • - инициирование (зарождение) цепи
I. Cl : Cl Cl • + Cl • - инициирование (зарождение) цепи
На стадии II и III происходит исчезновение одних и появление других свободных радикалов.
 |


 II. СН4 + Сl • •CН3 + НCl развитие
II. СН4 + Сl • •CН3 + НCl развитие
(рост) цепи

 III. • СН3 + Cl : Cl CH3Cl + Cl•
III. • СН3 + Cl : Cl CH3Cl + Cl•
Рост цепи продолжается до тех пор пока не прекратят свое существование свободные радикалы. При отсутствии свободных радикалов в реакционной смеси происходит обрыв цепи – IV. На стадии IV возможны разные варианты соединения радикалов, содержащихся в реакционной смеси.


 IV. • СН3 + Cl • CH3Cl; Cl • + Cl • Cl2; • СН3 + • СН3 СН3 - СН3
IV. • СН3 + Cl • CH3Cl; Cl • + Cl • Cl2; • СН3 + • СН3 СН3 - СН3
Аналогично идет, например, хлорирование этана:
СН3 - СН3 + Сl2 → Н3С – СН2Сl + НСl
Однако прямое хлорирование алканов с большей длиной углеродной цепи приводит к смеси продуктов, выделение из которой целевого хлорпроизводного является сложной задачей, в частности:
hv
 СН3 – СН2 – СН3 + Сl2 CH3 – CH2 – CH2Cl + CH3 – CH – CH3 + HCl
СН3 – СН2 – СН3 + Сl2 CH3 – CH2 – CH2Cl + CH3 – CH – CH3 + HCl
 пропан 1-хлорпропан
пропан 1-хлорпропан
Cl
2-хлорпропан
Галогенирование циклоалканов происходит в тех же условиях:

циклогексан бромциклогексан
(циклогексилбромид)
Бензол и его гомологи галогенируются (хлорируются) легче, чем алканы. Так, на холоду и в присутствии катализаторов (AlCl3, FeCl3) галоген замещает атомы водорода в бензольном кольце, а при нагревании или на свету без катализатора замещаются атомы водорода в боковой цепи:

1 – о-хлортолуол, 2 – п-хлортолуол, 3 – бензилхлорид, 4 – бензилиденхлорид, 5 – бензотрихлорид
Реакция идёт в газовой среде (пропускание хлора в парах толуола)
При высокой каталитической активности AlCl3 в процессе хлорирования бензола все атомы водорода могут быть замещены на галоген:
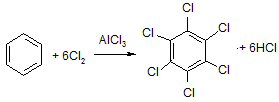
бензол гексахлорбензол
Под действием ультрафиолетового излучения без катализатора к молекуле бензола может присоединяться три молекулы хлора или брома:
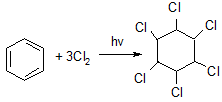
бензол гексахлорциклогексан (гексахлоран) –
промышленный способ получения
При высоких температурах (400-6000С) атомы водорода в алкенах замещаются на атомы галогена, не затрагивая двойной связи:
tºC
 СН2 = СН – СН3 + Сl2 CH2 = CH – CH2Cl + HCl
СН2 = СН – СН3 + Сl2 CH2 = CH – CH2Cl + HCl
пропилен аллилхлорид
2. Присоединение галогенов к ненасыщенным углеводородам в среде растворителя при комнатной температуре, в темноте (галогенирование алкенов):
 СН2 = СН2 + Br2 СН2Br – CH2Br
СН2 = СН2 + Br2 СН2Br – CH2Br
этилен 1,2 – дибромэтан
Механизм реакции начинается электрофильной атакой двойной связи молекулой брома. Молекула галогена поляризуется под влиянием π-электронов двойной связи и конечный атом Br, несущий частичный положительный заряд δ+, выступает как электрофильный агент, захватывая π- электроны двойной связи с образованием неустойчивого π- комплекса (I).

 +
+



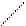 медленно СН2 – СН2 Н2С – CH2 быстро
медленно СН2 – СН2 Н2С – CH2 быстро





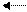
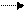
 СН2 = СН2 + Br2 CH2 = СН2 или + + Br- → СН2-СН2
СН2 = СН2 + Br2 CH2 = СН2 или + + Br- → СН2-СН2

 Вr: Вr Br Br
Вr: Вr Br Br
Br δ+ - Brδ - карбокатион ион бромония 1,2-дибромэтан
π –комплекс (δ-комплекс) (бромониевый катион)
I II III
Затем двойная связь и связь между атомами галогена разрываются гетеролитически с образованием δ-комплекса (II) или бромониевого катиона (III), из которых под действием аниона Br- быстро образуется 1,2-дибромэтан.
3. Присоединение галогеноводородов к ненасыщенным углеводородам
(гидрогалогенирование):
 CH2 = CH2 + HBr CH3 – CH2Br
CH2 = CH2 + HBr CH3 – CH2Br
этилен бромэтан

 + НCl CH2 = CHCl
+ НCl CH2 = CHCl
ацетилен винилхлорид
К несимметричным олефинам галогеноводороды присоединяются по правилу Марковникова т.е. водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода, а галоген - к другому ненасыщенному углеродному атому:
 СН3 – СН = СН2 + НCl CH3 – CH – CH3
СН3 – СН = СН2 + НCl CH3 – CH – CH3

Cl 2-хлорпропан
Механизм реакции подтверждает правило Марковникова:

I –энергетически не выгодный малоустойчивый карбкатион, т.к. положительный заряд компенсируется +I эффектом только одного радикала. II – энергетически выгодный устойчивый карбкатион, т.к. положительный заряд на С2 – атоме компенсируется +I эффектом двух СН3 – групп. Поэтому реакция идёт через устойчивый карбкатион II.
Необходимо отметить, что правило Марковникова соблюдается только при гетеролитическом механизме присоединения галогеноводородов к алкенам (АЕ). В присутствии перекисей (что характерно только для НBr) эти реакции протекают по радикальному механизму вопреки правила Марковникова (перекисный эффект Хараша):
НBr
 СН3 – СН = СН2 CH3 – CH2 – CH2Br
СН3 – СН = СН2 CH3 – CH2 – CH2Br
H2O2 1 - бромпропан
механизм реакции:
 2 НBr + O2 2Br • + H2O2; HBr + H2O2 Br • + [H3O2] •
2 НBr + O2 2Br • + H2O2; HBr + H2O2 Br • + [H3O2] •

 CH3 – CHBr –CH2•
CH3 – CHBr –CH2•
CH3 – CH = CH2 +Br •→ I
НBr

 CH3–CH–CH2Br CH3 – CH2 – CH2Br + Br• и т.д.
CH3–CH–CH2Br CH3 – CH2 – CH2Br + Br• и т.д.
II
I. менее устойчивый радикал т.к. свободный электрон вступает во
взаимодействие с электронным облаком только одной соседней С – Н
связи.
II. устойчивый радикал т.к. свободный электрон вступает во взаимодействие с
электронными облаками пяти соседних связей С – Н.
4. Получение галогенопроизводных из спиртов.
При действии на спирты галогеноводородом, пятихлористым фосфором (РСl5) или хлористым тионилом (SOCl2) гидроксильная группа замещается на атом галогена:
tºC,CaCl2
 С2Н5ОН + НСl C2H5Cl + H2O
С2Н5ОН + НСl C2H5Cl + H2O
этанол этилхлорид
(хлористый этил)
 С2Н5ОН + РCl5 C2H5Cl + РОСl3 + HCl
С2Н5ОН + РCl5 C2H5Cl + РОСl3 + HCl
пятихлористый хлорокись
фосфор фосфора
 С2Н5ОН + SOCl2 C2H5Cl + SO2↑ + HCl↑
С2Н5ОН + SOCl2 C2H5Cl + SO2↑ + HCl↑
хлористый
тионил
При использовании в качестве галогенирующего реагента галогеноводорода необходимо применять водоотнимающее средство (например CaCl2), которое связывает образующуюся воду и предотвращает гидролиз полученных галогеноалкилов.
В реакциях с РСl5 в качестве побочного продукта образуется хлорокись фосфора- жидкое вещество как и целевой продукт С2Н5Сl. Поэтому разделение этих двух жидкостей составляет дополнительные технологические трудности.
Наиболее удобно использовать в этих реакциях хлористый тионил, так как побочные продукты SO2 и НСl являются газообразными веществами, которые легко удаляются от основного продукта C2H5Cl.