 |
|
Химические свойства
Галогенопроизводные углеводородов являются одним из наиболее реакционноспособных классов органических соединений. Наиболее характерны для этого класса соединений реакции нуклеофильного замещения (SN) и отщепления (элиминирования, Е). Высокая реакционная способность галогенопроизводных в этих реакциях обусловлена строением их молекул. Так, в молекуле СН3Сl ковалентная связь между атомом углерода и галогеном поляризована из-за большой электроотрицательности атома хлора (-I- эффект). Поэтому электронная плотность у атома углерода понижается:

Вследствие этого углеродный атом легко атакуется молекулами или ионами, представляющими свою электронную пару (нуклеофильный реагент) для образования новой связи. Электроны разрывающейся связи уходят вместе с освобождающимся ионом:
 - (нуклеофильное замещение SN)
- (нуклеофильное замещение SN)
Субстрат нуклеофил продукт уходящая группа
Нуклеофильными реагентами называют атомы или группы атомов, а также молекулы, которые являются донорами электронной пары при образовании связи с любым элементом, кроме водорода.
Нуклеофильные реагенты (примеры)
а) отрицательно заряженные ионы:
:OH-, :I-, :CN-, CH3O:-, CH3C(O)O:-, :Br-, :Cl-
б) нейтральные молекулы, имеющие неподеленную электронную пару (НЭП) на гетероатомах:
H2O, CH3OH, NH3, CH3NH2, C6H5OH, C6H5NH2
реакционная способность галогеналканов в реакциях нуклеофильного замещения зависит от нескольких факторов:
а) от строения углеводородного радикала (линейное или разветвленное);
б) от галогена;
в) от атакующего нуклеофила;
г) от условий реакции (температура, наличие или отсутствие катализатора);
д) от характера растворителя, в котором идет реакция.
Указанные факторы влияют и на механизм реакции.
1. Реакции нуклеофильного замещения (SN1 и SN2)
Реакции нуклеофильного замещения в галогенах могут протекать по двум механизмам: SN1 – реакции мономолекулярного нуклеофильного замещения и SN2 – реакции бимолекулярного нуклеофильного замещения.
Реакции SN2 протекают при действии на субстраты* сильных нуклеофильных реагентов.
Одним из характерных примеров реакции SN2 является щелочной гидролиз метилбромида:
CH3-Вr + NaOH → CH3OH + NaBr
(NaOH + H2O)
Механизм реакции:
Скорость реакции SN2 подчиняется кинетическому уравнению второго порядка:
V = K[CH3Br][OH-]
т.е. пропорциональна концентрации субстрата и нуклеофилов – -ОН.
Таким образом в данной реакции в стадии, определяющей ее скорость, участвуют две частицы – Гидроксид – ион и метилбромид.
__________
*Субстрат – это один из реагентов, имеющий, как правило, более сложное строение.
Гидроксид – анион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома («с тыла»), как пространственно наиболее доступной стороны:

переходное состояние
(активированный комплекс)
По мере приближения к углеродному атому нуклеофильного реагента, последний оказывает все большее влияние на атомы водорода метильной группы – отталкивая их, что сопровождается постепенным удалением этих атомов друг от друга (атомы «раздвигаются»). В переходном состоянии атом углерода и три атома водорода метильной группы располагаются в одной плоскости, перпендикулярной плоскости доски. Угол между связями составляет 120ºС (sp2 - гибридизация). В переходном состоянии образование связи углерод – кислород и разрыв связи углерод – бром происходят одновременно. Отрицательный заряд в этом переходном состоянии распределен между вступающей (OH-) и уходящей (Br-) группами, а атом углерода остается практически незаряженным. Углы между связями в молекуле CH3ОН составляют, как и в субстрате, 109º (sp3 - гибридизация), но при этом происходит обращение конфигурации на противоположную (инверсия).
В реакциях SN2 реакционная способность галогеналканов определяется главным образом пространственными факторами и снижается с увеличением числа заместителей у атома углерода, связанного с галогеном:
СН3Х >СН3СН2Х>(СН3)2СНХ>>(СН3)3СХ
галогеналканы первичные вторичные третичные
галогеналканы галогеналканы галогеналканы
Реакции SN1 принципиально отличаются от реакций SN2 . Реакции SN1 часто протекают при действии на субстраты слабыми нуклеофильными реагентами, которые, как правило, являются и растворителями. Так, при использовании в качестве растворителя воды или спиртов протекают реакции гидролиза или алкоголиза соответственно. Примером реакции SN1 может быть, гидролиз трет – бутилбромида:

Механизм реакции:
В данном случае скорость реакции не зависит от концентрации воды, т.к. нуклеофил не участвует в первой стадии процесса. Реакция SN1 идет в соответствии с кинетическим уравнением 1 – го порядка V=K[(CH3)3CBr].
Это двухстадийный процесс. Первая стадия – диссоциация галогеналкана на ионы (мономолекулярная реакция):

карбкатион – стабилизирован
внутримолекулярными электронными эффектами (+I эффект)
Далее карбкатион быстро реагирует с молекулами реагента или растворителя, способными предоставлять пару электронов для заполнения вакантной орбитали положительно заряженного углеродного атома.
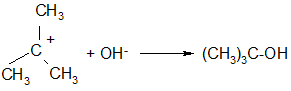 - эта стадия реакции протекает быстро
- эта стадия реакции протекает быстро
ОН- - реагент
 - процесс H2O – растворитель протекает быстро
- процесс H2O – растворитель протекает быстро
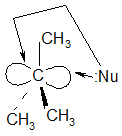 Карбкатион имеет плоское строение, поэтому он атакуется нуклеофилом равновероятно с обеих сторон образуются продукты – спирты одинаковой конфигурации с исходным бромалканом, и обратной конфигурации т.е. образуется эквимолекулярная смесь анантиомеров (рацемическая смесь).
Карбкатион имеет плоское строение, поэтому он атакуется нуклеофилом равновероятно с обеих сторон образуются продукты – спирты одинаковой конфигурации с исходным бромалканом, и обратной конфигурации т.е. образуется эквимолекулярная смесь анантиомеров (рацемическая смесь).
Реакционная способность галогеналканов в реакциях SN1 изменяется в обратном порядке по сравнению с SN2.
Третичный > вторичный >> первичный > СН3
Таким образом реакция замещения SN2 характерна для СН3X и первичных галогенпроизводных, а SN1 для третичных. В случае вторичных галогеналканов наблюдается смешанный механизм реакции.
Активность галогенопроизводных возрастает с увеличением молекулярной массы галогена: атом йода более подвижен чем хлора. Это связано с тем, что по мере увеличения размера атома уменьшается прочность связи между ядром и электронами внешней электронной оболочки, участвующими в образовании связи С-X. В ряду связей С-F, С-Cl, С-Br, С-I реакционная способность в процессах SN возрастает, поскольку в этом ряду увеличивается длина связи С-X, ее поляризуемость и легкость отщепления галогена.
Если атом галогена находится у ненасыщенного атома углерода или связан с углеродным атомом бензольного кольца, например, в молекулах винилхлорида (СН2=СНСl) или хлорбензола (С6Н5Сl), где С – атомы находятся в sp2 – гибридизации, происходит сопряжение орбиталий π- электронов двойной связи или бензольного ядра с НЭП атома галогена (+М эффект). Поэтому подвижность атома галогена в таких соединениях резко снижается. Если же галоген находится у атома углерода, расположенного в
α –положении к двойной связи (СН2=СН–СН2Cl - аллилхлорид) «аллильное» положение или – к углеродному атому бензольного кольца (С6 Н5 СН2Cl - бензилхлорид) – «бензильное» положение, то этот галоген обладает повышенной реакционной способностью в реакциях SN1. Это связано с более легкой диссоциацией связи С-X и дополнительной стабилизацией катиона за счет сопряжения.

Когда атом галогена еще больше удален от двойной связи или бензольного кольца, то он по своей реакционной способности не отличается от галогеналканов, например,
CH2=CH-(CH2)4-CH2-Cl; С6Н5-СН2-СН2-СН2-Cl
7-хлор-1-гептен 1-хлор-3-фенилпропан
При проведении реакции нуклеофильного замещения подбирают такой растворитель, в котором растворяются оба реагирующих вещества и который способствует разрыву связи С-X.
Используя реакцию нуклеофильного замещения, можно получать из галогеналканов не только спирты, но и другие классы органических соединений (нитрилы, амины, нитросоединения). Во всех этих реакциях в молекулу нового соединения вводится алкил, поэтому галогенпроизводные являются алкилирующими реагентами.
2.Реакции β-элиминирования (Е1 и Е2).
Отщепление галогеноводородов
Галогенопроизводные способны также отщеплять галогеноводороды с образованием олефинов. Отщепление происходит под действием на галогеналканы спиртовых растворов щелочей:

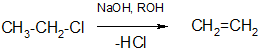
Элиминирование происходит по ионным механизмам Е1 и Е2.
Реакции, протекающие по Е1 – механизму, не требуют каких – либо реагентов, но необходим ионизирующий растворитель. Стадией определяющей скорость реакции, является образование интермедиата – карбкатиона, который переходит в стабильное состояние (олефин), отщепляя протон под действием появляющегося в реакционной смеси более основного алкоксил – иона (RO-).

эта стадия протекает быстро
Реакции отщепления Е1 обычно сопровождаются процессами замещения SN1.
Разветвленность алкильной группы способствует увеличению выхода олефина.
Реакции отщепления, протекающие по бимолекулярному механизму Е2, требуют присутствия основания. Отрыв протона и потеря галогена происходят одновременно (без промежуточного соединения), через переходное состояние, в котором нуклеофил образует связь с протоном в той мере, в какой происходит отщепление галогена:
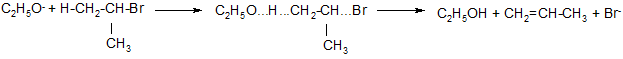
изопропилбромид переходное состояние
Скорость Е2 реакции пропорциональна концентрации обоих реагентов. Обычно на ряду с отщеплением происходит и нуклеофильное замещение по механизму SN2. Для первичных алкилгалогенидов преобладают реакции замещения, а для третичных – реакции элиминирования, причем в продуктах реакции всегда содержатся более замещенные алкены, энергетически более выгодные (правило Зайцева).
Активность оснований в реакциях, протекающих по механизму Е2, изменяется в том же направлении, что и их сила:
-NH2>C2H5O->-OH>CH3COO-
При обоих механизмах скорость отщепления Н – Х убывает в ряду: третичные > вторичные > первичные и I >Br > Cl.
Кроме указанных реакций нуклеофильного замещения (SN1 и SN2.) и β – элиминирования (Е1 и Е2) для галогенопроизводных характерны и другие превращения.]
3. Замещение атомов галогена водородом.
Это происходит при каталитическом гидрировании галогенопроизводных или действии на них водородом в момент выделения, а также иодоводородом:
H2,
катализатор
RI → RH + HI
C2H5I + HI → C2H6 + I2
4. Взаимодействие с солями галогеноводородной кислоты.
При этом если заменяют хлор бромом или иодом, то следует вести реакцию с солями щелочных металлов, хлориды которых труднее растворимы, чем бромиды и йодиды. При замещении галогена с большей атомной массой галогеном с меньшей массой необходимо применять соли серебра, т.к. иодид серебра менее растворим, чем бромид и особенно хлорид:

5.Реакция Вюрца
При взаимодействии галогеналкилов с металлическим натрием образуются алканы с удвоенным числом углеродных атомов:
2СН3(СН2)3Br + 2Na → CH3(CH2)6CH3 + 2 NaBr
1-бромбутан октан
6. Получение магнийорганических соединений.
При действии на алкилгалогениды магния в среде абсолютного эфира образуются магнийорганические соединения, называемые реактивами Гриньяра, например: эфир
СН3СН2I + Mg → CH3CH2MgI
йодэтан этилмагнийиодид
7. Реакции с алкоголятами
При взаимодействии алкилгалогенидов с алкоголятами образуются простые эфиры:
С2Н5Br + NaOC2H5 → С2Н5OC2H5 + NaBr
бромистый этилат диэтиловый
этил натрия эфир
При этом возможно образование непредельных углеводородов.
8. Взаимодействие с аммиаком и аминами
Продуктами реакции являются первичные, вторичные или третичные амины, а также соли аммониевых оснований:
NH3
CH3I + NH3 → [CH3NH3]+I- → CH3NH2 + NH4I и т.д.
первичный амин
(метиламин)
9. Взаимодействие с солями синильной кислоты
KCN
СН4 + Сl2 → CH3Cl → CH3CN (ацетонитрил)
Тем самым можно перейти от предельных углеводородов к карбоновым кислотам.
10. Взаимодействие с солями органических кислот:
t0C
C2H5I + AgO-C(O)CH3 → CH3C(O)OC2H5 + AgI
ацетат серебра этиловый эфир уксусной
кислоты(этилацетат)
11. Реакции с нитритом серебра:
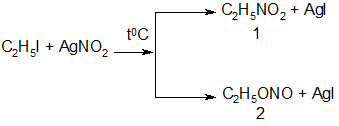
1-нитроэтан, 2-этилнитрит
В этой реакции атакующая нуклеофильная частица – NO2- проявляет двойственную реакционную способность (амбидентные свойства), т.е. может присоединять радикал по азоту (механизм SN2) или кислороду (механизм SN1):

1-нитросоединение, 2-нитрит
Механизм и направление реакции зависят от природы растворителя. Так, сольватирующие растворители (вода, спирты) способствуют образованию эфира.
12. Взаимодействие с металлами
При действии на галогенопроизводные многих металлов (двухкратный избыток) галоген замещается металлом. Это важный метод синтеза металлорганических соединений:
эфир
C2H5Br + 2 Li → C2H5Li + LiBr
этиллитий