 |
|
Функция распределения Больцмана:
n = no exp (- U/kT) , где U – потенциальная энергия частицы;
Вгравитационном поле эта функция имеет вид: n=no exp (- mgh/kT) – для частиц массой m, либо n = no exp (- Mgh/RT) –для молекул газа с молярной массой М.
Термодинамические свойства и процессы в идеальных газах.
«Нулевое» начало термодинамики постулирует равенство температуры во всех частях системы, находящейся в состоянии термодинамического равновесия.
I начало термодинамики является обобщением закона сохранения энергии на молекулярные системы: 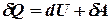
где  – бесконечно малое количество теплоты,
– бесконечно малое количество теплоты,  – элементарная работа,
– элементарная работа,  – бесконечно малое изменение внутренней энергии системы.
– бесконечно малое изменение внутренней энергии системы.
II начало термодинамики накладывает ограничение на процессы. По современной формулировке в изолированной системе возможны лишь процессы, которые сопровождаются неубыванием энтропии: DS£0. Для обратимых процессов изменение энтропии DS=  и для таких процессов II начало термодинамики записывается в виде : TdS=
и для таких процессов II начало термодинамики записывается в виде : TdS=  .
.
III начало термодинамики (теорема Нернста) сводится к двум утверждениям: 1) при приближении к абсолютному нулю энтропия стремится к определенному конечному пределу (этот предел полагается равным 0);
2) все процессы при абсолютном нуле температур идут без изменения энтропии.
Молярная теплоемкостьС – количество теплоты, необходимое для нагревания 1 киломоля вещества на 1К: С = dQ/ dT.
Молярная теплоемкость при постоянном объеме Cv= iR/2;
при постоянномдавлении: Cp = (i+2) R/2;  (соотношение Майера), где i – число степеней свободы молекул – число независимых компонент энергии молекулы в выражении для внутренней энергии газа. Для одноатомной молекулы i=3, двухатомной i=5, состоящей из 3-х и более молекулi=6.
(соотношение Майера), где i – число степеней свободы молекул – число независимых компонент энергии молекулы в выражении для внутренней энергии газа. Для одноатомной молекулы i=3, двухатомной i=5, состоящей из 3-х и более молекулi=6.
Процессы в газах
| процесс | Уравнение процесса | Теплоемкость С | ||||
Изотермический 
|  , ,
| С = ¥ | ||||
Изобарный 
| 
| 
| ||||
Изохорный 
| 
| 
| ||||
Адиабатический  =0
процесс без теплообмена =0
процесс без теплообмена
|  ; ; 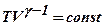
 g = Ср/СV = (i+2)/ i - показатель адиабаты
g = Ср/СV = (i+2)/ i - показатель адиабаты
| С = 0 | ||||
| Политропический С = const процесс с постоянной теплоемкостью |  ; ; 
 n=(C-Ср)/(C-СV) - показатель политропы
n=(C-Ср)/(C-СV) - показатель политропы
| С =  ,
где n - показатель политропы ,
где n - показатель политропы
| ||||
| процесс | Работа

| Теплота dQ = n СdT DQ = n СDT | Внутренняя энергия dU =n СV dT | Энтропия dS = dQ/T | ||
| Изотермический | 
| DQ = A | DU =0 | 
| ||
| Изобарный | A =n (Cp - СV)DT = =n R DT | DQ =n Сp DT | DU =n СV DT | 
| ||
| Изохорный | A=0 | DQ = n СVDT | DU =n СV DT | 
| ||
| Адиабатический | A = -DU | DQ = 0 | DU =n СV DT | DS =0 | ||
| Политропический | A =n (C- СV) DT | DQ = n СDT | DU =n СV DT | 
| ||
Коэффициент полезного действия тепловой машины h = А/ Q1 =(Q1 + Q2)/Q1),
Q1 – полученное, Q2 <0 – отданное машиной тепло в ходе цикла.
Коэффициент полезного действия цикла Карно h = (T1-T2)/T1
Т1 – температура нагревателя, Т2 – температура холодильника.
Явления переноса в идеальных газах
1. Среднее число столкновений молекул за время  =1сек Z=
=1сек Z= 
 и средняя длина свободного пробега молекул
и средняя длина свободного пробега молекул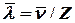 =
=  , где d – диаметр молекул, n – их число в единице объема,
, где d – диаметр молекул, n – их число в единице объема, 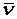 =
=  - среднеарифметическая скорость молекулы:
- среднеарифметическая скорость молекулы:
2. Явление диффузии – перенос количества молекул: In = - D  ; где D=
; где D=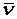
 /3 – коэффициент диффузии, In - поток молекул
/3 – коэффициент диффузии, In - поток молекул
3. Явление теплопроводности – перенос энергии:  =-
=- 
 ; где
; где  =
= 
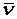

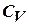 /3- коэффициент теплопроводности, r - плотность газа.
/3- коэффициент теплопроводности, r - плотность газа.
4. Явление вязкого трения – перенос импульса:  = -
= - 
 ; где
; где  =
= 
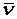
 /3 - коэффициент динамической вязкости.
/3 - коэффициент динамической вязкости.