 |
|
Отслеживание побочных эффектов
Однако эффективность – всего лишь одна сторона медали. Вместе с вопросом, какое лекарство наиболее эффективно, встает также вопрос безопасности препаратов. Как большинство других врачей, я постоянно удивляюсь, с каким энтузиазмом некоторые мои коллеги бросаются прописывать новые лекарства. Когда на рынке появляется новый препарат, эффективность и преимущества которого перед уже существующим, не были доказаны, перед врачами и пациентами встает простой выбор. Вы хотите применять старое лекарство с известной дозировкой, с побочными эффектами, с которыми мы научились справляться за время многолетнего опыта работы? Или вы хотите применять совершенно новый препарат, не имеющий никаких преимуществ перед старым, но который может, насколько мы знаем, вызывать ужасные неблагоприятные побочные реакции, готовые проявиться в любую минуту?
Меня учили в медицинском университете, что в такой ситуации врач должен относиться ко всем своим коллегам как к неоплачиваемым дублерам массовки: пускай они делают ошибки вместо вас, пускай бездельничают и остаются безучастными, учатся и приходят снова уже с безопасным лекарством. В некотором отношении можно сказать, что это полезный совет в целом по жизни. А как же в таком случае отслеживать побочные эффекты?
Когда лекарство лицензировано, необходимо оценить его безопасность. Это сложное, комплексное занятие, и, скажем честно, выполнить его достаточно трудно с точки зрения методологии, в которой не все организовано гладко. Изъяны в методике усугубляются ненужной секретностью, плохо организованным обменом информацией и нежеланием госорганов изымать лекарство с рынка. Чтобы понять это, нам нужно познакомиться с основами проведения фармакологического надзора.
Важно признать, до того как мы вообще начнем, что на рынок всегда будут попадать лекарства с непредвиденными побочными эффектами. Это происходит потому, что вам нужны данные по многим пациентам, чтобы зафиксировать редкие побочные эффекты, однако исследования, организованные с целью лицензирования препаратов, обычно проводятся в малых масштабах, и в них принимают участие от 500 до 3 000 человек. При помощи простой математической формулы, которая называется правилом трех, можно подсчитать, насколько часто должен проявляться побочный эффект, чтобы его можно было зафиксировать в такой маленькой группе людей. Если в рамках предлицензионных исследований наблюдается 500 пациентов, то этого количества достаточно, чтобы обнаружить побочные эффекты, которые проявляются чаще, чем у 1 из 166 человек. Если наблюдается 3000 пациентов, то этого достаточно только для того, чтобы выявить побочные эффекты, проявляющиеся у 1 из 1000 человек. Общее правило применять легко: если какой-нибудь побочный эффект еще не проявился у энного количества пациентов, то можно быть на 95 % уверенным, что такой эффект случается у менее чем одного из n/3 пациентов. Математическое объяснение истинности данного утверждения приведено в сноске ниже[5], если уж вам так хочется углубляться в детали, но лично у меня от него голова кругом идет. Вы также можете применять правило трех в обычной жизни. Если 300 парашютов раскрылись удачно, то вероятность того, что при каком-то прыжке один парашют не раскроется, при условии сохранения всех параметров неизменными, составляет, по крайней мере, менее 1 к 100. Это может успокоить вас, а может и нет.
На основе всего вышесказанного можно сделать вывод: ваше лекарство может буквально взорваться в организме каждого пятитысячного пациента. Их головы лопнут, их кишки вылетят наружу вследствие активации какого-нибудь механизма отторжения, который никто не мог предусмотреть. Но на тот момент, когда препарат лицензирован, после того как его приняли всего лишь 1 000 человек, очень вероятно, что вам так и не придется стать свидетелем хотя бы одной из описанных выше ужасных смертей. После того как 50 000 человек, настоящих пациентов из реального мира, примут ваше лекарство, можно ожидать, что вам станет известно всего о 10 пациентах, у которых лопнули головы и взорвались животы (так как в среднем препарат вызывает такую ужасную побочную реакцию у 1 из 5 000 человек).
Теперь, если ваше лекарство вызывает очень редкий побочный эффект, такой как взрыв организма изнутри, вы должны только радоваться этому, потому что странные неблагоприятные явления привлекают внимание людей – ведь раньше ни с кем ничего подобного не случалось. Люди начнут говорить о взорвавшихся пациентах, о них будут писать статьи в научные журналы, возможно, даже начнут уведомлять об этом разные государственные ведомства, попросят патологоанатомов сделать вскрытие тел умерших, забьют тревогу, и люди начнут искать то, что заставило взрываться головы и животы больных. Это может случиться довольно быстро, возможно, уже вскоре после того как взорвется голова у первого пациента.
Впрочем, многие из побочных эффектов, вызываемые лекарствами, уже много раз наблюдались ранее. Если ваш препарат повышает вероятность возникновения сердечной недостаточности, ну так что из того? Вокруг и так уже много людей с этим недугом, поэтому, если врачи и заметят еще одного больного с характерными симптомами, они, вероятно, не обратят на этот случай внимания, особенно если лекарство дается пожилым людям, которые и так часто имеют проблемы с сердцем. Иногда может оказаться сложным обнаружить сигнал, свидетельствующий о повышенной сердечной недостаточности, даже в большой группе пациентов.
Это помогает нам понять принцип действия различных механизмов, которые используются для мониторинга побочных эффектов фармацевтическими компаниями, государственными ведомствами по контролю за распространением медикаментов и учеными. Они подразделяются на три группы:
1. Спонтанные отчеты о побочных эффектах от пациентов и врачей, присылаемые в госведомства.
2. Эпидемиологические исследования, в ходе которых изучались истории болезней больших групп пациентов.
3. Отчеты с данными от фармакологических компаний.
Спонтанные отчеты – самая простая система. В большинстве стран мира, когда доктор подозревает, что у пациента наблюдается какая-нибудь неблагоприятная реакция на лекарство, он может уведомить об этом местный орган по надзору в области здравоохранения. В Великобритании это делается через систему желтых карточек. Эти карточки рассылаются бесплатно врачам, что делает систему простой в использовании. Пациенты же могут сообщать о подозреваемых ими неблагоприятных эффектах сами, зайдя на сайт yellowcard.mhra.gov.uk. (Прошу всех воспользоваться предоставленной возможностью.)
Эти спонтанные отчеты затем сортируются вручную по категориям и сводятся в одну гигантскую таблицу, где каждому лекарству, присутствующему на рынке, выделена одна строчка, а у каждого побочного эффекта, который только можно представить, есть колонка. Затем вы следите за тем, как часто сообщается о каждом побочном эффекте по каждому лекарству, и пытаетесь решить, является ли эта цифра выше той, которую вы умозрительно ожидали увидеть. Если вас интересует статистика, названия использованных инструментов, таких как «удельно отчетное соотношение» и «байесовские нейронные сети для воспроизведения уверенности», дадут вам ключ к пониманию того, как это делается. Если вас не интересует статистика, тогда вы ничего не теряете. По крайней мере, не больше, чем во всех остальных случаях.
Эта система хороша для обнаружения необычных побочных эффектов: лекарство, от которого взрывается голова и лопается живот, например, будет замечено очень быстро при помощи описанной выше таблицы. Системы, подобные этой, существуют также и в других странах, а большая часть полученных результатов стекается со всего мира в информационный центр ВОЗ и хранится в Уппсале (Швеция). Ученые или компании могут подать заявку на доступ к этим данным и с переменным успехом получить разрешение[6].
Однако этот подход имеет один серьезный недостаток: не все неблагоприятные эффекты фиксируют в отчетах. Рутинная оценка показывает, что в Великобритании только об одном случае из двадцати становится известно в MHRA (Агентство Великобритании по контролю за оборотом лекарств и медицинских товаров).38 И это происходит вовсе не из-за нерадивости докторов. Можно было бы сказать, что дела обстоят прекрасно, если бы суть проблемы заключалась в безалаберности медперсонала, потому что тогда мы бы знали, что у всех побочных эффектов, вызываемых всеми лекарствами, существует равная вероятность не попасть в отчет и не быть зафиксированными. Тогда можно было бы сравнить соотношение количества поданных отчетов о побочных эффектах друг с другом и с общим количеством лекарств.
К сожалению, о различных побочных эффектах от различных лекарств сообщается с различной частотой. Врач с гораздо большей долей вероятности заподозрит в симптоме побочный эффект, если пациент принимает препарат, недавно появившийся на рынке, поэтому о таких случаях будет сообщаться чаще, чем о неблагоприятных воздействиях, вызываемых давно используемыми лекарствами. Также, если у пациента проявляется побочный эффект, который уже давно известен и связан медициной с принимаемым им лекарством, врач в гораздо меньшей степени будет заниматься составлением отчета, чтобы сообщить о нем, так как это вовсе не новый сигнал, призывающий к соблюдению осторожности, а всего лишь еще один случай хорошо известного и неинтересного явления. А если в обществе медработников распространяются байки и ходят слухи о проблемах с лекарством, врачи будут более склонны к спонтанному сообщению о неблагоприятных эффектах не из-за желания подлить масла в огонь, а просто потому, что, скорее всего, будут лучше помнить, что прописывали пациенту не вызывающее доверия лекарство, когда он придет на прием снова, жалуясь на какой-нибудь необычный симптом.
Также подозрение врача, является ли данный симптом побочным эффектом, будет гораздо меньше, если синдром достаточно распространен. Например, у людей очень часто болят голова и суставы, или у кого-то вдруг в какой-то момент жизни находят раковую опухоль, поэтому лечащему врачу может просто не прийти в голову, что жалобы пациента вообще могут иметь хоть какое-то отношение к прописанному лекарству. В любом случае, эти побочные эффекты будет сложно заметить на фоне высокого числа жалоб больных, страдающих от традиционных симптомов, и в особенности это относится к тем случаям, когда после начала терапии с использованием нового лекарства проходит достаточно много времени.
Вести учет всех этих проблем чрезвычайно трудно. Так система спонтанных отчетов может оказаться полезной, если неблагоприятные события случаются очень редко без участия лекарств, либо возникают внезапно, либо же относятся к тому типу, который обычно связывают с неблагоприятными побочными эффектами от лекарств (скажем, сыпь или резкое снижение количества лейкоцитов). Но в целом, хотя эти системы важны и благодаря им в госведомства поступает много обоснованных тревожных сигналов, они используются только для выявления подозрений на побочные эффекты.39 Затем информация проверяется в виде данных, представленных в более робастной форме.
Более качественные данные можно получить при изучении историй болезней очень большого числа людей, участвовавших в так называемых эпидемиологических исследованиях. В США это сделать сложно, и самое большое, что вам удастся добиться, – это получить доступ к административной базе данных, использующейся для обработки платежной информации, относящейся к медицинским услугам, а в таких базах отсутствует большая часть нужных сведений. В Великобритании же мы находимся в более выгодном и необычном положении. А все потому, что в нашей стране медицинские услуги не только оказываются государством бесплатно на любом этапе, но и контролируются одним-единственным административным органом – Государственной службой здравоохранения. В результате этого удачного совпадения у нас есть большое число историй болезней, данные из которых могут использоваться для отслеживания полезных и вредных свойств медикаментов. Хотя мы и не осознали в полной мере всех преимуществ сложившейся ситуации, есть одно место под названием общая база данных практических исследований, где содержится несколько миллионов записей, сделанных врачами общей практики. Эта информация хорошо защищена, чтобы обеспечить анонимность пациентов, но теперь вот уже несколько лет исследователи фармацевтических компаний, госорганов и университетов могут подать заявку на доступ к некоторым разделам, содержащим закрытую информацию, чтобы проверить, наносят ли какие-либо конкретные лекарства вред здоровью пациентов. (Здесь я должен объявить о присутствии личного интереса к данному вопросу, потому что моя работа, как и работа многих других ученых, связана с анализом базы данных семейных врачей Великобритании, хотя я не занимаюсь исследованием побочных эффектов.)
Проверка безопасности лекарства по историям болезней пациентов, которым выписывались рецепты в ходе обычной клинической практики, по ряду причин имеет больше преимуществ перед сбором данных при помощи спонтанных отчетов. Во-первых, в истории болезни есть все необходимые записи, представленные в закодированной форме, и они отображаются в таком же виде, как и в компьютерной системе больниц, так что врачам не нужно решать, должны ли они фиксировать какой-либо конкретный эффект от лекарства или нет.
Есть также и преимущество перед теми маленькими сертификационными исследованиями, так как в вашем распоряжении имеется большой объем данных, позволяющих вам изучить редкие случаи. И более того – все это настоящие пациенты. Люди, которые принимают участие в специальных исследованиях, обычно являются «идеальными» больными: они здоровее, чем настоящие пациенты, у них меньше различных проблем медицинского характера, они принимают меньше лекарств, среди них, скорее всего, нет ни пожилых, ни тем более беременных и т. д. Фармацевтические компании любят тестировать свои лекарства на таких «идеальных» пациентах, так как здоровые люди, вероятнее всего, покажут привлекательные результаты и представят лекарство в выгодном свете. Они также с большей долей вероятности выдадут положительный результат в более короткий период, а на исследования будет затрачено меньше средств. На самом деле это еще одна причина считать, почему исследования с использованием информации из базы данных более предпочтительны: сертификационные исследования обычно не длятся долго, поэтому пациенты подвергаются воздействию лекарства в течение гораздо меньшего промежутка времени, чем когда препарат выписывают по рецепту. А записи из базы данных помогают нам понять, как лекарства воздействуют на настоящих пациентов, живущих в реальном мире и в реальных условиях (и как мы увидим, этот аспект важен не только при изучении вопроса побочных эффектов).
При помощи этих данных можно искать связи между конкретным лекарством и повышенным риском наступления неблагоприятного события, которое принадлежит к числу широко распространенных, таких как, например, сердечный приступ. Так можно сравнить риск возникновения сердечного приступа у пациентов, которые, например, получали три различных типа противогрибкового препарата, если вы заподозрили, что одно из этих средств может негативно сказаться на сердце. Конечно, при такой работе нет идеально прямых связей частично потому, что вам придется принимать важные решения о том, что с чем сравнивать, и это может повлиять на конечные выводы. Например, нужно ли сравнивать пациентов, принимающих сомнительный, с вашей точки зрения, препарат, с другими пациентами, принимающими сходное лекарство, либо лучше сопоставить их с людьми того же возраста, не принимающими никаких лекарств? Если вы выберете последнее, можно ли быть уверенным в том, что ваши пациенты, лечащиеся от грибка, точно соотносимы со здоровыми пациентами того же возраста, присутствующими в базе данных? Или же пациенты с грибком стопы больше склонны страдать диабетом?
Вы также можете стать жертвой так называемого «синдрома перестраховки», когда пациентам, у которых замечали проблемы при приеме лекарств в прошлом, на всякий случай прописывают преимущественно препарат с проверенной историей. В результате среди больных, принимающих безопасное лекарство, оказывается много людей, которые более нездоровы и поэтому с большей долей вероятности проявят неблагоприятную реакцию, которая никак не будет связана с прописанным им лекарством. Дело может закончиться тем, что безопасное средство станет считаться хуже, чем оно есть на самом деле, а в перспективе более сомнительное лекарство в сравнении с ним приобретет более хорошую репутацию.
Но в любом случае, проведение быстрых масштабных проверок действия лекарств в процессе предоставления каждодневных медицинских услуг – не такая уж и безумная идея, как мы увидим позднее. Такого рода исследования – лучшее, что можно сделать для проверки безопасности лекарства и подтверждения отсутствия у него каких-либо серьезных побочных эффектов. Поэтому они проводятся государственными контролирующими органами, учеными и зачастую производителями лекарств по требованию госоргана.
На самом деле, фармацевтические компании связаны рядом обязательств, принуждающих их отслеживать побочные эффекты препаратов, как общие, так и специальные, и сообщать о них в соответствующее ведомство, однако в реальности эта система работает не очень хорошо. В 2010 году, например, Управление по контролю за качеством пищевых продуктов и лекарственных веществ отправило двенадцатистраничное письмо Pfizer, жалуясь на то, что компания должным образом не сообщает о неблагоприятных реакциях на свои препараты, которые начали возникать у пациентов после получения сертификата для продажи средств на рынке.40 Управление провело шестинедельное расследование и подтвердило наличие у некоторых лекарств несколько серьезных и неожиданных побочных воздействий, о которых не сообщалось в нужные госорганы: например, было обнаружено, что «Виагра» вызывает серьезные проблемы со зрением и даже слепоту. Представители Управления по контролю за качеством пищевых продуктов и лекарственных веществ заявили, что Pfizer не сообщала об этих проблемах в нужный срок, «отнеся их к другому классу расстройств и снизив серьезность представленной в отчете проблемы, низводя ее до незначительного уровня без наличия на то каких-либо оснований». Вспомните недавнюю историю с пароксетином, когда компания GSK умолчала в отчетах о важных данных о самоубийствах пациентов. И это не отдельные случаи.
В итоге вы можете также получить отдельные данные по побочным эффектам из исследований, даже если нежелательные реакции, которые мы пытаемся выявить, редки и, таким образом, с гораздо меньшей долей вероятности проявятся при проведении мелкомасштабных проверок. Хотя и тут опять наблюдались проблемы. Например, фармацевтические компании могли иногда объединить несколько проблем разных типов в одну группу, название которой в действительности не отражало реальное положение вещей и того, что на самом деле происходило с пациентами. При проверке антидепрессантов такие побочные реакции, как суицидальные мысли, суицидальное поведение и попытки самоубийства, были названы «эмоциональной неустойчивостью», «поступлением в больницу» и «безрезультатностью терапии» или «выбыванием из исследования».41 Ни одно из этих определений не отражает сути случившегося с больными.
Пытаясь решить проблемы подобного рода, несколько лет назад ЕМА обязало фармацевтические компании составлять план по управлению рисками по выпускаемым лекарствам, что вызвало возникновение новых проблем. Такого рода планы составляются представителями компаний. В них описываются исследования безопасности лекарств, которые были согласованы с контролирующим госорганом, однако по какой-то совершенно невообразимой и глупой причине содержание этих документов было засекречено. Поэтому никто точно не знает, какие именно исследования были согласованы с компаниями к проведению, каким вопросам безопасности отдавался приоритет при изучении и как именно они проходили.
Вниманию врачей, ученых и общественности было представлено краткое сводное резюме. После его изучения научные работники начали опубликовывать работы, посвященные оценке содержания вышеупомянутых документов, возмущаясь результатами проведенных работ.42Один из врачей, объяснив, что изменения в рисках, обозначенные в плане по управлению рисками, были представлены врачам в бессистемном и несуразном виде, сказал: «Основной промах этого исследования – недостаток открытых для общего доступа данных, касающихся наиболее важных аспектов». Исследователи были просто лишены информации об испытаниях, которые были проведены для отслеживания безопасности лекарства. В ходе другого, похожего на предыдущее исследования (оно было не таким засекреченным, как все прошлые) были изучены результаты проверки безопасности лекарств, описанные в плане по управлению рисками.43 Примерно для половины этих исследований в плане по управлению рисками не хватало данных: было приведено лишь краткое описание или же заверение провести некое исследование, но отсутствовала какая-либо другая информация. В полной версии плана по управлению рисками, где исследователь ожидал найти подробные протоколы исследований, не нашлось ни одного документа хотя бы на какое-нибудь из 18 лекарств из тех, что изучались в ходе проверки.
Если эти планы по управлению рисками составляются втайне, а их содержание не доводится до публики в полной мере, но при этом одновременно используется как инструмент для прокладывания пути лекарству на рынок с предоставлением минимума подтверждающей информации, тогда мы столкнулись с новой проблемой, серьезной и интересной: возможно, эти документы используются как средство для успокоения общественности, а не для решения самого вопроса.44
Когда дело доходит до секретности в госучреждениях, это свидетельствует о том, что существует важная проблема культурного плана, решением которой необходимо заняться. Я потратил уйму времени, пытаясь понять логику мышления государственных служащих, среди которых попадаются действительно неплохие люди. Похоже, многие из них уверены, что, на всякий случай, желательно все же скрывать документы от глаз публики. Все, что я вынес из общения с ними, можно выразить следующей мыслью: в госорганах полагают, что решения относительно выпуска лекарств на рынок должны выносить именно они и что такие решения лучше принимать за закрытыми дверями. До тех пор, пока их решения правильны, доводить результаты исследований до внешнего мира в форме резюме допустимо. Я думаю, такая точка зрения превалирует в кругах госслужащих, однако она ошибочка по двум причинам. Мы уже видели много примеров, когда сокрытые данные могут стать ширмой для неудач и промахов, и сколько глаз подчас нужно для того, чтобы заметить проблему. Твердое убеждение работников госорганов, что мы должны слепо полагаться на их суждения, также нельзя назвать верной позицией.
Госчиновник и врач пытаются принять два абсолютно разных решения по какому-либо лекарству, даже если они используют (или желают использовать, если речь идет о врачах) одну и ту же информацию. Чиновник пытается ответить на вопрос, послужит ли интересам общества в целом появление на рынке его страны некоего нового лекарства, пусть даже в некоторых очень неясных обстоятельствах, как, например, когда остальные средства не принесли пользы. Врач же решает, нужно ли использовать это лекарство прямо сейчас для лечения пациента, стоящего перед ним. Оба используют данные по безопасности и эффективности лекарства, к которым у них есть доступ, но и тому, и другому нужен доступ к полной информации, чтобы принять эти два разных решения.
Эти весомые различия понимают не все пациенты и не везде. Они часто думают, что сертифицированное лекарство безопасно и эффективно. В 2011 году в ходе опроса, в котором принимали участие 3 000 человек, было выяснено: 39 % опрошенных полагают, что Управление по контролю за качеством пищевых продуктов и лекарственных веществ выдает разрешение только на «чрезвычайно эффективные» лекарства, а 25 % думают, что организация сертифицирует только лекарства, не обладающие серьезными побочными эффектами.45 Однако все это далеко от правды: госорганы часто сертифицируют лекарство, эффективность которого очень незначительна, а побочные эффекты ужасны, лишь на всякий случай, надеясь, что препарат окажется полезным хоть для кого-нибудь в обстоятельствах, когда другого выхода уже не осталось. Такие препараты прописываются врачами, принимаются пациентами как второсортное средство, однако нам нужны все факты, чтобы принимать взвешенные и продуманные решения.
Некоторые могут возразить, что в завесе секретности появились прорехи после принятия в Европе нового законодательства о фармакологическом надзоре, которое вступило в силу в 2012 году и призвано улучшить прозрачность,46 однако это законодательство в лучшем случае можно назвать спорным. Оно не открывает доступ к планам по управлению рисками, но в нем говорится, что ЕМА должно публиковать такие документы, как повестка дня, рекомендации, мнения участников и протокол заседания различных комитетов по науке, которые на данный момент остаются полностью засекреченными. Можно будет оценить пользу от этого незначительного изменения по тому, как ЕМА собирается выполнять это предписание, если вообще будет, и как мы уже видели, предыдущие действия ЕМА не прибавили уверенности. Даже если закрыть глаза на то, с каким удивительным пренебрежением отнеслись в ЕМА к отчетам о клинических исследованиях по орлистату и римонабанту, о которых говорилось в главе 1, следует вспомнить, что это же ведомство потребовало от всех компаний предоставить журналы проведения открытых клинических исследований на несколько лет вперед, однако требуемого предоставлено не было, а данные исследований до сегодняшнего дня держатся в секрете.
В любом случае это законодательство имеет ряд весомых недостатков.47 ЕМА теперь хотят сделать организацией, где будет размещаться единая база данных, например, по безопасности лекарств, однако эту информацию все равно собираются держать в тайне от работников здравоохранение, ученых и общественности. Самый весомый недостаток этого нового законодательства имеет отношение к организационным моментам.
Многие ратовали и до сих пор призывают создать новое агентство по фармакологической безопасности, которое занималось бы отслеживанием рисков медикаментов после того, как лекарства попадают на рынок. Это должна быть независимая организация со своими полномочиями и штатом, отдельная от той, в обязанности которой входит выдача сертификатов на лекарство, прежде чем оно впервые попадет на рынок.48 Возможно, такие призывы звучат как нечто отвлеченное, не относящееся к организационным моментам, однако на самом деле такого рода высказывания возникают ввиду наличия одного из самых весомых изъянов, который только был выявлен в системе работы государственных агентств по контролю за фармакологическими средствами всего мира: госорганы, лицензировавшие лекарство, часто неохотно выдают санкцию на его изъятие с рынка, боясь, как бы в их действиях не усмотрели некомпетентность, в результате которой не удалось заметить проблему с первого раза.
Это не просто словоблудие, не имеющее отношения к реальной жизни. В 2004 году эпидемиолог из Службы по фармакологическому контролю США, который занимался обзором «Виокса», заявил в Сенате финансового комитета: «Мой опыт с „Виоксом“ является хорошим примером того, как департамент Управления по контролю за качеством пищевых продуктов и лекарственных веществ CDER (Центр по изучению и оценке лекарственных средств) в целом реагирует на серьезные вопросы, касающиеся фармакологической безопасности. Отдел, который занимался проверкой нового лекарства и изначально выдал разрешение на его выпуск на рынок, видит в нем собственное дитя, и чаще всего это единственное крупное препятствие, стоящее на пути эффективного решения серьезных вопросов безопасности в сфере фармакологии и контроля за лекарственными препаратами». Ужасно то, что в 1963 году, полвека назад, представитель Управления по контролю за качеством пищевых продуктов и лекарственных веществ Джон Нестор сказал в Конгрессе почти то же самое. «Решения о выдаче лицензий на выпуск лекарств на рынок незыблемы, – заявил он. – Мы не имеем права оспаривать вердикты, вынесенные в прошлом».
Это универсальная проблема политики и системы управления в госорганах. Ее можно заметить и в организационной структуре других учреждений: по всему миру департаменты, ответственные за осуществление контроля фармакологической безопасности и изъятие опасных препаратов с рынка, гораздо меньше по размерам и гораздо менее влиятельны, чем департаменты по сертификации лекарств, что заставляет ведомства неохотно принимать решения об изъятии препаратов. Поскольку мы обсуждаем вопросы управления и организационной структуры и вы можете заподозрить меня в том, что я привожу лишь непроверенные, голословные утверждения, позвольте вам сказать, что такие же выводы делались организаторами всех серьезных исследований госорганов,49 например, Институтом медицины.50 Такое же мнение выражено и в полуофициальной биографии Управления по контролю за качеством пищевых продуктов и лекарственных веществ,51 и его разделяют ряд различных ученых52 и люди, состоящие на службе в самих организациях.
По этой причине в Евросоюзе так часто призывали создать новое Агентство по фармакологической безопасности, и поэтому так беспокоит то, что эти призывы были проигнорированы. Ведь на самом деле для сертификации медикаментов до сих пор используются те же самые старые модели, меняются лишь названия лекарств. Комитет ЕМА по изучению и оценке лекарственных средств, который принимает решения по изъятию сертифицированного лекарства с рынка, все равно является подотчетным Комитету по продуктам для использования в медицинских целях – организации, изначально выдающей лицензии на медикаменты. Сложившаяся ситуация усугубляет все старые проблемы и откладывает их решение: препарат изъять с рынка сложно, весь процесс идет медленнее, чем сертификация лекарства, а все это действует на нервы тем, кто выдал сертификат.
Так какие же шаги должен предпринять орган по надзору за распространением лекарств, когда стало известно о наличии проблемы? В самых крайних случаях госведомство может изъять препарат с рынка (хотя в США лекарства фактически остаются на рынке, просто Управление по контролю за качеством пищевых продуктов и лекарственных веществ просто рекомендует не использовать их). Обычно ведомство выпускает предупреждение для врачей через один из своих каналов, путем рассылки писем, начинающихся словами «Уважаемый доктор такой-то…», или внося изменения в текст на этикетке (на самом деле к лекарству прилагается памятка или инструкция по применению) к препарату. Обновленная информация по безопасности лекарств высылается большинству врачей, хотя до конца не понятно, читают ли большинство из них такие послания. Удивительно то, что, когда государственное ведомство решает уведомить врачей о побочных эффектах, фармацевтическая компания может опротестовать решение и затягивать отсылку уведомлений месяцами или даже годами.
Так, например, в феврале 2008 года Агентством Великобритании по контролю за оборотом лекарств и медицинских товаров была опубликована небольшая статья в бюллетене «Вестник безопасных лекарств», которую прочитал лишь ограниченный круг специалистов. В статье говорилось, что Агентство планировало внести изменения в текст этикетки для всех статинов (класс препаратов, назначаемых для снижения уровня холестерина и предотвращения сердечных приступов). Такое решение было принято после изучения обзора данных клинических исследований, спонтанных отчетов и статей, которые наводили на мысль о связи между развитием неблагоприятных реакций и приемом данных лекарств. «Информация по использованию статинов обновляется. В инструкцию по использованию лекарств будет внесен ряд различных побочных эффектов, которые вызывают все препараты из группы статинов». Далее приводилось объяснение: «Пациентов нужно проинформировать о том, что лечение любыми статинами может иногда вызывать депрессию, нарушение сна, расстройство памяти и сексуальную дисфункцию». Агентство планировало также выпустить и новое предупреждение о том, что очень часто терапия статинами может быть причиной интерстициальной болезни легких – серьезного заболевания.
Решение добавить информацию обо всех этих побочных эффектах на этикетку было сделано в феврале 2008 года, однако заявление о том, что они наконец внесены, озвучили лишь в ноябре 2009 года. Понадобилось почти два года, чтобы воплотить задуманное в жизнь. Почему? «Бюллетень терапевтической медицины» нашел причину: «Один из создателей лекарств и держатель лицензии на выпуск одного из препарата на рынок заявил, что компания не согласна со способом подачи информации в инструкции по использованию лекарства».53 Таким образом, фармацевтическая фирма смогла откладывать внесение предупреждения об опасности целой группы препаратов, прописываемых четырем миллионам человек в Великобритании, в течение 24 месяцев только потому, что она не была согласна с нюансами корректировок, которые надлежало внести в текст на этикетке.
Но в любом случае, какая была бы польза от этого предупреждения, даже если бы оно и появилось вовремя?
Наша история подошла к концу. Врачам и пациентам трудно получить четкую, ясную, актуальную картину о рисках и положительных эффектах лекарств из любого источника, но поскольку у государственных ведомств есть привилегия доступа к информации, мы должны ожидать от них выполнения конкретных, четких действий по передаче данных, которые есть у них в наличии, а не торговаться с фирмами: госведомства – единственные учреждения, которые имеют доступ ко всем данным.
Этикетки к лекарствам рекламируются госведомствами как единственный, наиболее надежный источник информации, откуда подписчики и пациенты могут узнать обо всех свойствах препарата. На самом деле текст на этикетке организован хаотично и не очень информативен. Часто приводится описание исследования, но не дается ссылка на источники, что не позволяет узнать подробности или хотя бы догадаться, о каком исследовании идет речь. Иногда основные элементы исследования так отличаются друг от друга в документе госведомства и в опубликованной статье, что сложно увидеть в них сходство, даже если результаты исследования были опубликованы. Более того, на большинстве этикеток приводится длинный список побочных эффектов, но при этом дается очень мало информации, насколько они часто наблюдаются, а ведь многие из них очень редки и не связаны с приемом лекарства напрямую. В приведении избыточной информации, которая подается хаотично, смысла так же мало, как и в предоставлении слишком малого количества информации.
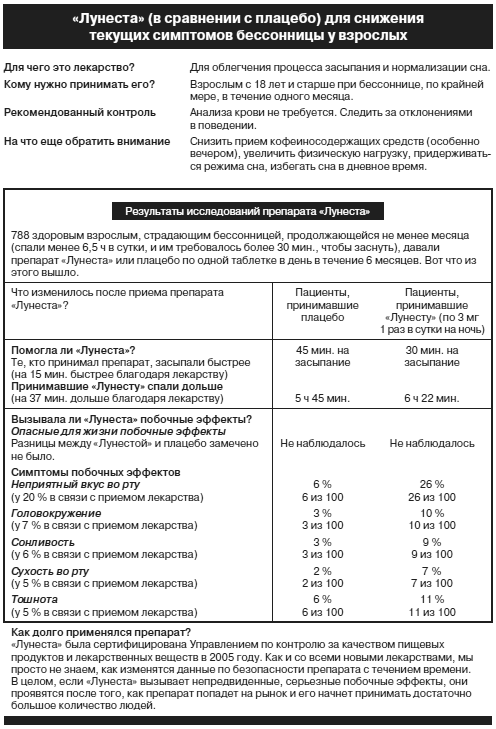
Несколько американских исследователей на протяжении 10 лет предлагали добавить простую памятку с перечислением свойств препарата вдобавок к информации, представленной вниманию врачей и пациентов. Такая памятка должна прилагаться к довольно мелко напечатанной и путанно составленной инструкции по использованию препарата. В ней до сведения простых людей доводилась бы сводная информация с четкими количественными данными по рискам и полезным эффектам лекарства и со статистикой, основанной на фактических данных. Результаты рандомизированного, контролируемого исследования показывают, что пациенты, которым дали такие памятки с перечислением фактов о лекарстве, лучше понимают его риски и полезные свойства.54 В Управлении по контролю за качеством пищевых продуктов и лекарственных веществ сообщили, что подумают об их использовании. Надеюсь, что когда-нибудь случится чудо, и Управление само займется выпуском таких кратких памяток к каждому лекарству.
Вы можете сами увидеть разницу. Ниже представлена памятка с фактами по снотворному под названием «Лунеста».
Эта памятка короче, чем официальная инструкция для того же препарата, которая приведена на следующей странице. Я тоже думаю, что она гораздо информативнее. Она не решает всех проблем секретности или даже проблем плохой связи. Но она демонстрирует очень ясно, что госорганы ни заработали, ни заслужили их специальный статус, когда дело доходит до оценки и сообщения о рисках.


Решения
Мы установили, что существует ряд серьезных проблем и в системе лицензирования лекарств, и в порядке контроля за их безопасностью после выпуска на рынок. Госведомства выдают лицензии на продажу препаратов, основываясь на слабых подтверждающих фактах, которые не демонстрируют преимущества новых лекарств перед уже имеющимися на рынке средствами, а иногда даже выдают сертификат на лекарство, вообще не имеющее никаких полезных свойств. В результате рынок наводнен посредственными препаратами. Информация по ним не собирается, несмотря на наличие законодательно закрепленного права, позволяющего обязать компании провести более качественные исследования, и несмотря на многочисленные обещания производителей лекарств выполнить такие работы. Наконец, данные по побочным эффектам собираются несколько бессистемно, а документы и планы по управлению рисками остаются засекреченными, спрятанными от врачей и больных без всяких на то оснований. О результатах отслеживания безопасности лекарств сообщается непоследовательно, по нечасто используемым каналам, а при передаче по ним происходит значительная утеря информации, также компании затягивают процесс передачи данных, что приводит к большим задержкам.
Мы можем смириться с некоторыми из этих проблем, но если они все долгое время остаются нерешенными, это создает опасную ситуацию, в которой здоровью пациентов причиняется вред из-за недостатка знаний. Не страшно, если рынок, например, наводнен посредственными лекарствами или такими, качество которых хуже аналоговых препаратов. Если врачи и пациенты знают об этом, они могут быстро и без вреда для себя выбрать нужное средство. Однако это невозможно, если нам ничего не известно о вредных и полезных свойствах препаратов. Всегда были и будут существовать программы и внедряться меры, направленные на поддержание этих стандартов: NICE (Национальный институт здравоохранения и качества медицинской помощи), попросив предоставить больше сравнительных данных, чтобы вынести решение по отношению цены и качества, сделал благое дело. С моей точки зрения, для исправления ситуации требуется изменить сознание людей и их отношение к появлению на рынке новых лекарств. Но прежде чем сделать это, нужно обязательно выполнить несколько простых мероприятий.
1. Фармацевтические компании нужно обязать предоставлять данные, показывающие, как их новое лекарство сравнивалось с лучшим имеющимся на текущий момент препаратом. Информация должна быть предоставлена по каждому новому лекарству до того, как оно попадет на рынок. Пусть иногда будет лицензироваться лекарство, полезные свойства которого не так хороши, как у его имеющегося на рынке аналога. Если у пациента наблюдается реакция отторжения на обычно используемое средство, полезно иметь у себя в арсенале другие, менее действенные препараты. Однако нам нужно знать относительные риски и полезные свойства медикаментов, если мы хотим принимать осознанные решения.
2. Государственные ведомства и спонсорские организации, оплачивающие оказание медицинских услуг, должны использовать свое влияние, чтобы заставить компании проводить больше информативных исследований. Правительство Германии лидирует на этом поприще, так как еще в 2010 году основало агентство IQWiG, которое занимается изучением фактов, подтверждающих действие новых сертифицированных лекарств, с целью принятия решения, должны ли они оплачиваться компаниями Германии, оказывающими медицинские услуги, или нет. IQWiG оказалась достаточно смелой, чтобы потребовать проведения качественных исследований с выполнением оценки реальных результатов, и уже отказала в оплате за некоторые лекарства, по которым были поданы неубедительные подтверждающие факты. В результате компании отложили выпуск новых лекарств на рынок в Германии и теперь занимаются поиском более убедительных данных, подтверждающих, что препарат действительно оказывает определенный эффект.55 Пациенты не введены в заблуждение, так как нет весомых фактов, доказывающих эффективность этих новых лекарств. Германский рынок лекарств – самый большой в Европе. Он насчитывает 80 млн пациентов, проживающих в далеко не бедной стране. Если все покупатели по всему миру откажутся покупать лекарства, эффективность которых подтверждена слабо, тогда компании будут вынуждены проводить качественные исследования гораздо быстрее.
3. Вся информация о неблагоприятных и полезных свойствах лекарств, которую предоставляют фармацевтические компании в государственные ведомства, должна находиться в открытом доступе, а все данные должны храниться в международных и национальных органах надзора, кроме информации частного характера. Это не только обеспечит открытость и прозрачность деятельности, но и принесет ряд других преимуществ. При наличии свободного доступа к информации о лекарствах мы можем прибегнуть к помощи сразу нескольких специалистов для решения различных проблем, связанных с данным конкретным препаратом, анализируя его более тщательно и рассматривая с разных точек зрения. Росиглитазон, лекарство от диабета, был удален с рынка из-за побочного действия на сердце, однако эта проблема была выявлена не государственным агентством по надзору за медикаментами, а учеными, работающими над данными, которые вдруг стали более доступными обществу для ознакомления, благодаря судебному разбирательству. Вредные свойства «Виокса» были замечены независимыми учеными, не принадлежащими к кругу работников госведомств. Опасные свойства препарата от диабета под названием бенфлуорекс опять-таки были выявлены не госорганом, а независимыми учеными. Чиновники государственных органов не должны быть единственными, у кого есть доступ к подобного рода данным.
4. Мы должны стремиться создать лучшую площадку для информирования пациентов о полезных и неблагоприятных свойствах лекарств. В госорганах используются косные, формальные, устаревшие подходы, не приносящие результатов, а сами госслужащие действуют в интересах ведомства, а не в интересах врачей и пациентов. Если вся информация абсолютно доступна, ее можно облечь в более подходящую для использования форму, и это может сделать любой, у кого есть доступ к ней. Данное мероприятие должно быть проведено за счет общественных фондов и продано, в зависимости от бизнес-модели.
Все это просто. Но есть более общий вопрос, которому ни одно правительство не уделило должного внимания, так как чиновников больше волнуют аспекты культуры в медицине: нужно проводить больше исследований. Если мы не можем точно сказать, какое лекарство лучше, нужно просто сравнить два разных препарата между собой и выбрать то, которое будет эффективнее влиять на болезнь и иметь менее тяжелые побочные эффекты.
Всего этого можно достичь, и в конце следующей главы я изложу свои предложения относительно того, как можно проводить исследования дешево, эффективно и почти универсальным способом. Такой подход можно будет использовать на стадии лицензирования каждого нового лекарства и на протяжении всего лечения. Но сначала я хочу рассказать вам о том, какие чудовищные нарушения имеют место во время проведения фармацевтическими компаниями клинических исследований.
Глава 4