 |
|
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Министерство образования и науки Российской Федерации
| Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «МАТИ – Российский государственный технологический университет имени К. Э. Циолковского» |

Кафедра «Моделирование систем и информационные технологии»
РАСТВОРЫ
Методические указания
К практическим занятиям
по курсу «ХИМИЯ»
Составители:
Белова С.Б.
Белов С.П.
МОСКВА 2013
Методические указания к практическим занятиям
по дисциплине «Химия» / сост. С.Б.Белова, С.П.Белов ─ М.: ИТЦ МАТИ, 2013. - 20 с.
© Белова С.Б.,
Белов С.П.
составление, 2013
© ИТЦ МАТИ,
оформление, 2013
Цель работы Получить теоретические навыки определения состава жидких растворов.
.
Растворы
Растворы — это однородные смеси (гомогенные системы) переменного состава, содержащие два или более вещества.
Изсоставных частей раствора одно вещество считается растворителем, остальные — растворенными веществами. Растворитель — этовещество, в среде которого равномерно распределяются растворенные вещества; растворитель является основной составной частью раствора и обычно присутствует в нем в большем количестве. Растворитель может образовывать растворы различных растворенных веществ, например растворы разных солей в одном и том же растворителе — воде, а одно и то же растворенное вещество может давать растворы в различных растворителях, например растворы бромида натрия в воде и этаноле как растворителях.
В отличие от гомогенных смесей растворов, гетерогенные системы (суспензии, эмульсии и др.) к растворам не относятся, а представляют собой дисперсные системы. Растворы отличаются от дисперсных систем по размерам частиц дисперсной фазы, т. е. частиц растворенного вещества; имеется иряд других отличий (табл.1).
В широком смысле под растворами понимаются гомогенные смеси в любом агрегатном состоянии. В химической практике более важны жидкие гомогенные смеси, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии обычно называют просто растворами. В качестве же дисперсной фазы для получения жидких растворов могут быть использованы вещества, находящиеся в любом состоянии (твердом, жидком или газообразном).
Примеры. Водный раствор диоксида углерода,  водный раствор жидкого этанола
водный раствор жидкого этанола  ; водный раствор твердого гидроксида натрия
; водный раствор твердого гидроксида натрия  .
.
Таблица 1. Некоторые характеристики растворов и суспензий
| Истинный раствор | Коллоидный раствор | Суспензия |
Молекулярно-дисперсная система
Размер частиц  м
Частицы нельзя обнаружить оптическими методами м
Частицы нельзя обнаружить оптическими методами
| Коллоидно-дисперсная система
Размер частиц  Частицы можно обнаружить с помощью ультрамикроскопа
Частицы можно обнаружить с помощью ультрамикроскопа
| Грубодисперсная система
Размер частиц  м
Частицы можно обнаружить визуально или с помощью микроскопа
Частицы задерживаются бумажным фильтром м
Частицы можно обнаружить визуально или с помощью микроскопа
Частицы задерживаются бумажным фильтром
|
| Частицы проходят через бумажный фильтр |
Важно то, что после смешивания жидкого растворителя ирастворенного вещества в любом агрегатном состоянии образующаяся гомогенная смесь (раствор) остается жидкой.
Наиболее распространенным и широко применяемым в химической практике растворителем является вода. Кроме нее, но в значительно меньших масштабах, в неорганической химии используются жидкий аммиак и жидкий диоксид серы. В органической химии в качестве растворителей применяются этанол, ацетон, тетрахлорид углерода. трихлорэтилен, сероуглерод. бензол и др.
Растворы имеют чрезвычайно большое практическое значение; в лабораторных и в промышленных условиях большинство химических реакций проводят в растворах. Кроме того, именно в растворах протекают химические реакции, лежащие в основе обмена веществ в живых организмах.
Растворы делятся на истинные и коллоидные растворы; различия между ними приведены выше (см. табл. 1). В истинных растворах (часто называемых просто растворами) частицы растворенных веществ невидимы ни визуально, ни с помощью микроскопа. Частицы относительно свободно передвигаются в среде растворителя: в этом отношении они ведут себя подобно молекулам газа.
В качестве растворенных веществ в истинных растворах могут содержаться неэлектролиты в виде молекул и электролиты о виде ионов.
Пример. Глюкоза — неэлектролит в водном растворе и находятся врастворе в видемолекул; хлорид кальция  —электролит в водном растворе и содержится в растворе в виде ионов
—электролит в водном растворе и содержится в растворе в виде ионов  и
и  .
.
Вещества сочень большими поразмерам и очень сложными по составу молекулами (макромолекулами) способны образовывать отдельные фазы и поэтому давать коллоидные растворы (дисперсные системы). В коллоидных растворах дисперсная фаза обычно находится в виде частиц, имеющих диаметр от  до
до  м и содержащих от тысяч до миллиарда атомов.
м и содержащих от тысяч до миллиарда атомов.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание в насыщенном растворе. Потому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в 1 литре насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы раствора. Иногда выраженную этим способом растворимость называют коэффициентом растворимости. Если в 100 г воды растворяется более 100 г вещества, то такое вещество принято называть хорошо растворимым. А если растворяется менее 1 г вещества – малорастворимым. И, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость веществ, пока неизвестны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак). И наоборот.
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором

 Кристалл + Растворитель Насыщенный раствор
Кристалл + Растворитель Насыщенный раствор  Q,
Q,
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде щелочей, многих солей лития, магния, алюминия.
Зависимость между растворимостью и температурой очень удобно изображать графически – в виде кривых растворимости. При построении кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной – растворимость вещества при соответствующей температуре. На рис. 1 приведено несколько характерных кривых растворимости.
 Как видно из рис. 1, растворимость
Как видно из рис. 1, растворимость  увеличивается при повышении температуры очень медленно, а
увеличивается при повышении температуры очень медленно, а  - очень быстро.
- очень быстро.
Рис.1. Кривые растворимости (г/100г  )
)
Более сложный вид имеет кривая растворимости сульфата натрия. При 32,4 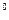 С кристаллогидрат его распадается и переходит в безводную соль. Этому и соответствует излом кривой растворимости, которая, в сущности говоря, состоит из двух отдельных кривых: до 32,4
С кристаллогидрат его распадается и переходит в безводную соль. Этому и соответствует излом кривой растворимости, которая, в сущности говоря, состоит из двух отдельных кривых: до 32,4 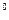 С насыщенный раствор находится в равновесии с осадком, состоящим из
С насыщенный раствор находится в равновесии с осадком, состоящим из  , выше этой температуры - с безводным
, выше этой температуры - с безводным  . Резкое изменение хода кривой показывает, что растворимость обоих веществ существенно различна. То же наблюдается и для кристаллогидратов с различным содержанием воды: каждый из них имеет свою характерную для него растворимость.
. Резкое изменение хода кривой показывает, что растворимость обоих веществ существенно различна. То же наблюдается и для кристаллогидратов с различным содержанием воды: каждый из них имеет свою характерную для него растворимость.
При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т.е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие – взаимно растворяются лишь до известного предела. Т.е. если взболтать диэтиловый эфир с водой, то образуются 2 слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками. Это воздух, который был растворен в воде. Он выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух.
Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры растворимость газа увеличивается.
При растворении газа в жидкости устанавливается равновесие:

 Газ + Жидкость Насыщенный раствор газа в жидкости
Газ + Жидкость Насыщенный раствор газа в жидкости
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т.е. к увеличению растворимости газа.
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК(Междунаро́дный сою́з теорети́ческой и прикладно́й хи́мии, IUPAC,International Union of Pure and Applied Chemistry,) , концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.