 |
|
Нормальная концентрация
(мольная концентрация эквивалента, или «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
 ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентности (фактор эквивалентности 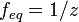 ).
).
Фактор эквивалентности feq - отношение эквивалентной молярной массы к его собственной молярной массе.
Эквивалент – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно- восстановительной – одному электрону.
Примеры.
1) В кислотно-основной реакции
3H2SO4 + 2Al(OH)3= Al2(SO4)3+ 6H2O
шести ионам водорода ( в трех реагирующих частицах H2SO4) соответствуют две молекулы Al(OH)3. Следовательно, одному иону водорода эквивалентна 1/3 молекулы Al(OH)3. Т.е. эквивалент Al(OH)3. = 1/3 Al(OH)3.
2) В реакции окисления-восстановления
H2SO4 разб. + Mg = MgSO4 + H2
Атом магния теряет два электрона: Mg0 - 2е→ Mg2+, поэтому 1 эквивалент магния составляет ½ Mg.
Величины 1/3 и ½ - факторы эквивалентности feq.
Эквивалентная масса – масса 1 эквивалента вещества.
Эквивалентные массы (Э) сложных веществ вычисляются по формулам:
Эоксида=Моксида/Число атомов элемента∙валентность элемента
Экислоты=Мкислоты/ Основность кислоты
Эоснования=Моснования/ Кислотность основания
Эсоли=Мсоли/Число атомов металла∙валентность металла.
Так, мольная масса Al(OH)3= 78,0 г/моль, а эквивалентная масса в приведенном примере = 1/3 мольной массы и = 26,0 г/моль.
Атомная масса Mg =24,3 г/моль, а эквивалентная масса в приведенном примере = 1/2 его атомной массы и = 12,15г/моль.
Для веществ с feq.=1, См=Сн.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
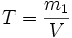 ,
,
где:m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то
есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
 , где
, где
- νi — количество i-го компонента, моль;
- n — число компонентов;
В таблице приведены наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе:
Таблица.