 |
|
Гальванические элементы
Гальванические элементы – это системы, состоящие из двух электродов, в которых энергия химических реакций превращается в электрическую энергию.
Различают 2 вида гальванических элементов:
 Биметаллические элементы – системы, состоящие из двух различных электродов.
Биметаллические элементы – системы, состоящие из двух различных электродов.
Примером такого гальванического элемента является медно-цинковый гальванический элемент (Якоби-Даниэля). В соответствии с рядом напряжений металлов цинк зарядится отрицательно, а медь положительно. При замыкании внешней цепи, в ней возникнет электрический ток, причем электроны с цинковой пластинки будут переходить на медный электрод, присоединяясь к осаждающимся на нем катионам меди. Таким образом, цинковый электрод будет анодом, т.к. на нем проходит процесс окисления цинка, а медный электрод будет катодом, т.к. на нем происходит восстановление меди. Растворы ZnSO4 и CuSO4 связаны «солевым мостиком». Солевой мостик – это стеклянная U-образная трубочка, наполненная агар-агаром, набухшим в насыщенном растворе КСl .
Каждая электродная пара имеет три характеристики:
Схема элемента:
Zn/ Zn2+ // Cu/ Cu2+
Солевой мостик в схеме имеет условное обозначение - две наклонных черты.
Химическая реакция, протекающая в нем:
Анод: Zn – 2ē → Zn2+ - процесс окисления
Катод: Cu2+ + 2ē → Cu - процесс восстановления.
Zn + Cu2+ → Zn2+ +Cu - суммарная химическая реакция.
ЭДС любого элемента – это разность электродных потенциалов катода и анода:
Е = ек - еа = е Cu/ Cu2+ - е Zn/ Zn2+
Используем уравнение Нернста для расчета электродных потенциалов (n=2):

Преобразуем полученное уравнение, учитывая выражение для стандартной ЭДС:
Е0= еоCu/ Cu2+ - ео Zn/ Zn2+
Получим уравнение для расчета ЭДС гальванического элемента:
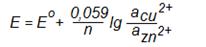

Изометаллические (концентрационные) элементы – это системы, состоящие из двух одинаковых электродов, погруженных в растворы одинаковых солей, но разной концентрации. Как было показано выше, при мѐньшей концентрации соли преобладает процесс окисления металла (по правилу Ле-Шателье), а при бóльшей концентрации соли растворе преобладает процесс восстановления катионов металла из раствора: первый электрод будет анодом, а второй электрод будет катодом.
Характеристики элемента:
1. Схема элемента:
Анод Ag/ Ag+(C1) // Ag/ Ag+(C2) Катод
С1 ˂ С2
2. Электродная химическая реакция:
Анод: Ag – ē → Ag+ - процесс окисления
Катод: Ag+ + ē → Ag - процесс восстановления
Ag +Ag+ → Ag+ + Ag - суммарная реакция
3. Расчет ЭДС элемента с учетом уравнения Нернста:
Е = ек - еа

Пренебрегая коэффициентом активности (f) при расчете эффективной концентрации (активности) ионов Ag+ (aAg+) и учитывая, что n = 1, получим уравнение для расчета ЭДС изометаллического элемента:
Е = 0,059 lg С1 / С2