 |
|
Диффузионный и мембранный потенциалы
При создании любой электродной пары всегда используется «солевой мостик». Использование «солевого мостика» решает несколько задач, которые возникают перед исследователями электрохимических процессов. Одной из таких задач является увеличение точности определений, путем устранения или значительного уменьшения диффузионного потенциала. Диффузионный потенциал в гальванических элементах возникает при соприкосновении растворов разных концентраций. Электролит из раствора с большей концентрацией диффундирует (переходит) в менее концентрированный раствор. Если абсолютные скорости движения катионов и анионов диффундирующего электролита различны, то менее концентрированный раствор приобретает потенциал знака заряда «более быстрых ионов», а более концентрированный раствор приобретает потенциал противоположного знака. Чтобы устранить диффузионный потенциал, необходимо минимизировать различие в скоростях движения катионов и анионов диффундирующего электролита. Для этого был выбран насыщенный раствор KCl, т.к. абсолютные скорости движения K+ и Cl¯ практически одинаковы и имеют одно из самых высоких значений.
Значение диффузионного потенциала значительно возрастает, если растворы электролитов разных концентраций разделены мембраной, пропускающей только катионы или анионы. Избирательность таких мембран обусловлена их собственным зарядом. Мембранные потенциалы очень устойчивы и могут сохраняться в течение нескольких месяцев.
Потенциометрия
Виды электродов
Для аналитических и технических целей разработано много разных электродов, образующих электродные пары (элементы).
Существует два основных вида классификации электродов.
По химическому составу:
• Электроды 1 рода– это электроды, электродная реакция которых, обратима только лишь по катиону или по аниону. Например, электроды, образующие элемент Якоби-Даниэля – медный и цинковый (см. выше).
• Электроды 2 рода– это электроды, электродная реакция которых обратима для двух видов ионов: и катионов и анионов.
• Окислительно-восстановительные электроды (Red – Ox). Под термином «Red – Ox – электрод» понимают такой электрод, где все элементы полуреакции (и окисленная и восстановленная форма) находятся в растворе. Металлические же электроды, погруженные в раствор, в реакции не участвуют, а служат лишь переносчиком электронов.
По назначению:
• Электроды сравнения.
Электроды сравнения – это такие электроды, потенциал которых точно известен, устойчив во времени и не зависит от концентрации ионов в растворе. К таким электродам можно отнести: стандартный водородный электрод, каломельный электрод и хлорсеребряный электрод. Рассмотрим каждый электрод подробнее.
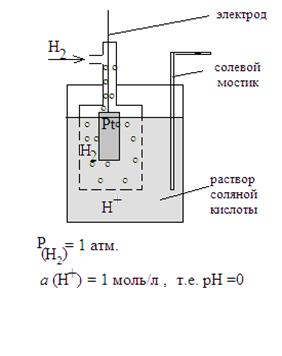 Стандартный водородный электрод.
Стандартный водородный электрод.
Этот электрод представляет собой закрытый сосуд, в который введена платиновая пластинка. Сосуд заполнен раствором соляной кислоты, активность ионов водорода в котором равна 1 моль/л. В сосуд под давлением 1 атмосфера пропускают газообразный водород. Пузырьки водорода адсорбируются на платиновой пластинке, где происходит их диссоциация на атомарный водород и окисление.
Характеристики стандартного водородного электрода:
1.Схема электрода: Pt(H2) / H+
2.Электродная реакция: ½ Н2 – ē ↔ Н+
Как легко видеть, данная реакция обратима только для катиона (Н+), поэтому стандартный водородный электрод – это электрод 1 рода.
3.Расчет электродного потенциала.
Уравнение Нернста принимает вид:

Таким образом, при а н+ =1 моль/л и р(н2) = 1 атм потенциал водородного электрода равен нулю и называется «стандартным водородным потенциалом».
Другой пример – каломельный электрод (см. рисунок)
Он содержит пасту, включающую каломель (Hg2Сl2), ртуть и хлорид калия. Паста находится на чистой ртути и залита раствором хлорида калия. Внутрь этой системы погружена платиновая пластинка.
Характеристики электрода:
1.Схема электрода: Hg2Cl2 , Hg(Pt) / Cl¯
2.В этом электроде происходят две параллельных реакции:
Hg2Cl2 ↔2Hg+ +2Cl¯
2 Hg+ + 2ē →2Hg
Hg2Cl2 + 2ē → 2Hg +2Cl¯ - суммарная реакция.
Из приведенных уравнений видно, что каломельный электрод – это электрод 2 рода.
3.Потенциал электрода определяют по уравнению Нернста, которое после соответствующих преобразований принимает вид:

Еще один важный пример – хлорсеребряный электрод (см. рис). 
Здесь серебряная проволока покрыта слоем трудно растворимой соли AgCl и погружена в насыщенный раствор хлорида калия.
Характеристики электрода:
1. Схема электрода: Ag, AgCl / Cl¯
2. Электродные реакции:
AgCl ↔ Ag+ + Cl¯
Ag+ + ē → Ag
AgCl + ē ↔ Ag + Cl¯ -суммарная реакция.
Как видно из этой реакции, образующийся металл оседает на проволоке, а ионы Cl¯ переходят в раствор. Металлический электрод приобретает положительный заряд, потенциал которого зависит от концентрации (активности) ионов Cl¯.
3.Потенциал электрода определяют по уравнению Нернста, которое после соответствующих преобразований принимает уже известный вид:
В хлорсеребряном и каломельных электродах концентрация ионов Cl¯ поддерживается постоянной и поэтому их электродные потенциалы являются известными и постоянными во времени.
• Электроды определения – это такие электроды, потенциал которых зависит от концентрации каких-либо ионов в растворе, поэтому по величине электродного потенциала можно определить концентрацию этих ионов.
Далее рассмотрим только те электроды, потенциал которых зависит от концентрации ионов водорода, т.е. связан с величиной рН.
Наиболее часто в качестве индикаторных электродов используют: водородный, стеклянный и хингидронный электроды.
Водородный электрод устроен аналогично стандартному водородному электроду, но если в ёмкость водородного электрода поместить кислый раствор с активностью ионов Н+ больше единицы, то на электроде возникает положительный потенциал, пропорциональный активности (т.е. концентрации) протонов. При уменьшении концентрации протонов, наоборот, электрод будет заряжаться отрицательно. Поэтому, определяя потенциал такого электрода, можно рассчитать рН раствора, в который он погружен.
Характеристики электрода.
• Схема электрода: Pt(H2) / H+
• Электродная реакция: ½ Н2 – ē ↔ Н+
• 
Т.к. n =1, а e o Н2/Н+ = 0, то уравнение Нернста принимает вид:

Стеклянный электрод представляет собой серебряную пластинку, покрытую нерастворимой солью серебра, заключенную в стеклянную оболочку из специального стекла, заканчивающимся тонкостенным токопроводящим шариком. Внутренней средой электрода является раствор соляной кислоты. Потенциал электрода зависит от концентрации Н+ и определяется по уравнению Нернста, имеющего вид:
e ст = e ост + 0.059 lg ан+
Хингидронный электрод состоит из платиновой пластинки, погруженной в раствор хингидрона – равномолярной смеси хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, между которыми быстро устанавливается динамическое равновесие:

Так как в данной реакции участвуют протоны, потенциал электрода зависит от рН.
Характеристики электрода:
1. Схема электрода: Pt / H+, С6Н4О2 , С6Н4О2-
2. Электродная реакция:
С6Н4(ОН)2 - 2ē ↔ С6Н4О2 + 2Н+ -
окислительно-восстановительный процесс.
3. Потенциал электрода определяют по уравнению Нернста, которое после соответствующих преобразований принимает вид:
ех.г. = еох.г. + 0,059 lg a H+
Хингидронный электрод используется только для определения рН тех растворов, где значение водородного показателя не больше 8. Это связано с тем, что в щелочной среде гидрохинон ведет себя как кислота и величина электродного потенциала перестает зависеть от концентрации протонов.
Т.к. в хингидронном электроде пластинка из благородного металла погружена в раствор, содержащий и окисленную и восстановленную форму одного вещества, то его можно рассматривать как типичную «red – ox» - систему.
Компонентами окислительно – восстановительной системы могут быть как органические, так и неорганические вещества, например:
Fe3+ / Fe2+ (Pt).
Однако, для органических веществ, «red – ox» - электроды особенно важны, т.к. являются единственным способом образовать электрод и определить его потенциал.
Величины электродных потенциалов, возникающих на металлических пластинках в red – ox – системах, можно рассчитывать не только по уравнению Нернста, но и по уравнению Петерса:

e0– стандартный окислительно-восстановительный потенциал, который возникает в системе при соотношении концентраций окисленной и восстановленной форм соединения равном 1.
Например, записать уравнение Нернста или Нернста–Петерса для следующих систем:
a) Cu2+ + 2ē → Cu;
b) Fe3+ + ē → Fe2+
E(Cu 2+/Cu) = +0.337 + RT/2F lnС Cu2+
При 25 оС :
E(Cu2+/Cu) = +0.337 +0.06/2 lgС Cu2+
E(Fe3+/Fe2+) = +0.771 + RT/1F lnСFe3+/СFe2+
При 25 оС :
E(Fe3+/Fe2+) = +0.771 + 0,06lnСFe3+/СFe2+