 |
|
Реакция нулевого порядка
Основные законы химии: фундаментальные, стехиометрические (закон кратных отношений, закон постоянного состава (дальтониды и бертоллиды). Закон эквивалентов и расчет эквивалентных масс элементов и соединений. Закон объёмных отношений, закон Авогадро и следствия, уравнение Менделя Клапейрона.
Закон кратных отношений — Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
Закон постоянства состава — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
Дальтониды — научный термин, которым обычно обозначают вещества постоянного качественного и количественного состава, который не зависит от способа получения. Название происходит от имени английского учёного Джона Дальтона.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
Mэкв = Mа/B, где Mэкв – масса эквивалента;Mа – атомная масса элемента; B – валентность.
Закон объемных отношений - Объемы вступающих в реакцию газов относятся друг к другу и у объемам образующихся газообразных продуктов реакции как небольшие целые числа.
Закон Авогадро —«в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул
Первое следствие - один моль любого газа при одинаковых условиях занимает одинаковый объём.
Второе следствиt: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
уравнение Менделеева — Клапейрона


2. Понятия Атом, Молекула, Радикал, Хим. элемент. Модели строения атома в истории. Планетарная модель Бора. Квантов- механическая модель: уравнение де Бройля и неопределенность Гейзенберга. Понятие волновой функции. Ур-е Шредингера, его физ. смысл.
Радикал — группа атомов, содержащая углеводородный остаток в молекуле.
Радикал — по представлениям Лавуазье, группа атомов, переходящих без изменения из одного соединения в другое.
Квантово-механическая модель строения атома
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
Де- Бройлья

где  — время,
— время,  .
.
Неопределенность - Если имеется несколько (много) идентичных копий системы в данном состоянии, то измеренные значения координаты и импульса будут подчиняться определённому распределению вероятности — это фундаментальный постулат квантовой механики. Измеряя величину среднеквадратического отклонения  координаты и среднеквадратического отклонения
координаты и среднеквадратического отклонения  импульса, мы найдем что:
импульса, мы найдем что:
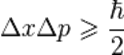
Волнова́я фу́нкция, или пси-функция  — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
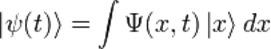
уравнения Шрёдингера —  зависимость от времени
зависимость от времени
3. Квантовые числа. Уровень, подуровень, орбиталь. Принцип Паули, правило Хунда. Последовательность заполнения уровней 1-7 периода. Примеры строения s-, p-, d-, f- элементов, их положение в таблице и св-ва. Электронные формулы в основном и возбужденном состояниях, валентные возможности.
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали | Положительные целые числа: 1, 2, 3... |
| Орбитальное | l | Форма орбитали | Целые числа от 0 до n-1 |
| Квантовое | m | Ориентация | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона | +½ и -½ |
При́нцип Па́ули (принцип запрета) — два и более тождественных частиц не могут одновременно находиться в одном квантовом состоянии.
Правило Хунда - заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон c с другим спином.
Порядок заполнения электронами атомных орбиталей определяется:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s


Современная формулировка периодического закона Менделеева. Понятие стехиометрическая валентность, степень окисления (окислительное число). Периодичность изменения свойств элементов. Радиусы атомов, потенциал ионизации, сродство к электрону, электроотрицательность.
Свойства простых тел и соединений, ими образуемых, находятся в периодической зависимости от относительных масс их атомов".
Свойства химических элементов и их соединений находятся в периодической зависимости от их порядковых номеров
Стехиометрическая валентность элемента показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
По периоду слева направо:
заряд ядра атома - увеличивается;
радиус атома - уменьшается;
количество электронов на внешнем уровне - увеличивается;
электроотрицательность - увеличивается;
сродство к электрону - увеличивается.
По группе сверху вниз:
заряд ядра атома - увеличивается;
радиус атома - увеличивается;
количество электронов на внешнем уровне - не изменяется;
электроотрицательность - уменьшается;
прием электронов - уменьшается.
Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Более общее понятие-энергия ионизации Е, миним. энергия, необходимая для удаления электрона из частицы на бесконечность. Она связана с потенциалом ионизации соотношением
5.Химическая связь, ее особенности и характеристики (энергия, длинна, полярность). Ковалентная связь, ее направленность и насыщенность, сигма и п связь. Метод валентных связей. Обменный и донорно акцепторный механизм обр. связи. Гибридизация связи и геометрия молекул. Метод молекулярных орбиталей. Энергетические диаграммы строения молекул ММО элементов 1 и 2 периодов. Химическая связь в металлах. Металлы, полупроводники и диэлектрики. Ионная связь.
Химическая связь – это совокупность сил, действующих между атомами или группой атомов. Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую.Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия.
К основным характеристикам химической связи относятся:
● длина связи – это межъядерное расстояние между химически связанными атомами. Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность;
● кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает;
● энергия связи – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Водородная связь и ее влияние на свойства вещества. Межмолекулярные взаимодействия. Связь между химической связью и свойствами веществ. Кристаллическое и аморфное состояние веществ. Стеклообразные сплавы, примеры. Аллотропия и полиморфизм. Фуллерены.
Возникают между водородом и очень электроотрицательными элементами. Может быть внутремолекулярной и межмолекулярной. При кипении разрушается, при плавлении нет.
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей
Межмолекулярное взаимодействие.
Межмолекулярные силы – силы вандерВаальса. Они слабее ковалентных, проявляются на больших расстояниях.
Кристалы и аморфы.
У кристаллов высокая температура плавления, упругая деформаця, дальний и ближний порядок анизотропии.
У аморфов нет конкретной температуры плавления, вязкая деформация, только ближний порядок – изотропия – не зависит от напраления (отсылка к кристаллографии). Отсутствует решетка.
Стекло, сплавы, полимеры.
При некоторых условиях жидкость, охлаждаясь, может стать стеклом – перейти в аморфное состояние. Стеклом могут быть простые в-ва – углерод, фосфор, сера, оксиды – бора, кремния, фосфора, галогениды.
Физические и химические свойсва аморфного в-ва могут отличаться от свойств образующего кристала. Стеклообразный диоксид Ge например более активен.
Аллотропия – существование двух и более версий одного хим элемента, различных по составу и свойствам. Типо, диоксид кислорода – просто кислород, триоксид – озон. Или фосфор – белый, красный, черный.
Полиморфизм – Полиморфи́зм криста́ллов — способность тв. вещества существовать в различных кристаллических структурах, называемых полиморфными модификациями. Одно вещество существует в разных формах с разной крист. Структорой, но одним составом. CaCo3 – кальцид и арагонит одновременно.
Фулерены - полициклические структуры сферического типа в вакууме состоящие из углерода. Молекула фуллеренов могут содержать от 20 до 540 углеродов
Самый устойчивый – С60
Термодинамика химических процессов. Тепловой эффект химической реакции. Законы термохимии. Функции состояния (внутренняя энергия, энтальпия, энтропия, энергия Гиббса). Внутренняя энергия и энтальпия. 1 закон термодинамики. Теплоты (энтальпии) образования веществ и энергия связи. Энтропия, 2, 3 закон термодинамики. Энергия Гиббса и направленность химических процессов. Принцип Бертло-Томпсона.
Термодинамика изучает законы превразения энергии из одной формы в другую в различных процессах. Выделяют общую и физическую, техническую и химическую.
Химическая.
1) предсказание возможности протекания химических реакций
2) о направлении химической реакции
3) о характере химического процесса.
Для термодинамики является характерным рассматривание равновесных систем.
Система называется равновесной если в любой точк системы значения параметров состояния одинаковы и не изменяются самопроизвольно во времени.
Уравнение состояния = f(P,V,T)=0. Для n молей PV=nRT
Термодинамическя система может переходить из одного состояния в другое в результате протекания термодинамического процесса.
Процесс – совокупность последовательных состояний, через которые проходит система при взаимодействий ее с внешней средой.
Обмен энергией между системой и окр средой может происходить двумя путями
1) передача теплоты – Q=m(дельта)T где делта Т=Т2-Т1
Если известно вещество то Q=cm(дельта)Т
Суд=джоуль/гр*градус Cm=джоуль/моль*градус
2) выполнение работы – А=-Р(дельта)V
Кроме P,V,T к функции состояния относится E
V=E(k)-E(п)
Ек-энергия движения частиц, Еп-элекростатическая, V-функция состояния.
Два закона термодинамики.
1) а)невозможно создать вечный двиг первого рода (работает без затрат энергии)
2) дельтаV=Q-A (дж)

Дельта H – энтальпия, функция состояния системы.
Теплота, поглощенная системой при постоянном давлении равна изменению энтальпии (дельтаH=Q)
Изменение энтальпии показывает теплоту реакции. дельтаH=H2-H1 – теплота реакции.
дельтаH – в зависимости от P реакция может быть эндо или экзотермической.
Количество выделенной или поглощенной теплоты называют тепловым эффектом реакции.
Основной закон термохимии (закон Гесса)
Тепловой эффект процесса не зависит от пути перехода, а зависит только от вида и состояния исходных веществ и конечных продуктов. Qv=дельтаV, Qp=дельтаV+A
Следствия закона Гесса:
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):

Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):

Чтобы предсказать возможно ли самопроизвольное протекание реакции необходимо ввести понятие энтропии S – мера хаоса.
S=f(P,V,T)
Существование энтропии определено 3 законом Термодинамики.
Теплота не может переходить от холодного тела к горячему.
Дельта S>=0. > для необратимых процессов dS>Q/T. = для обратимых dS=Q/T
S=k*ln(w) к- константа Больцмана = 1,38*10-16
Для процессов при Т и Р = конст. Течение процесса определяет энергия Гибса. dG=H-T*S
dG<0 – прямое протекание.
dG>0 - процесс невозможен при данных условиях.
dG=0 - состояние химического равновесия.
dG = -RTlnK. К – константа равновесия.
Третий закон (теорема Нернста)
Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система.
S=klnW W-термодинамическая вероятность.
Принцип Бертоло-Томпсона.
Принцип определяющий направление течения реацкии согласно которому все самопроизвольные процессы протекают в направлении наибольшего теплообразования.
8.Кинетика химических реакций. Закон действующих масс для гомогенных и гетерогенных реакций. Молекулярность и порядок реакции. Уравнение Аррениуса и правило Вант-Гоффа. Энергия активации и ее экспериментальное определение.
Хим кинетика – раздл химии, изучающий закономерности протекания реакция во времени, зависимости этих закономерностей от внешних условий, а так же механизмы химических превращений.
Скорость реакции
A+B=C+D скорость=dL/dT=-dF/dt
Закон действующих масс.
Скорость химической реакции пропорциональна концентрации реагентов в степенях, равных стехиометрическим коэффициентам в уравнениях реакций.
Скорость=k*CAa*BbB
Константа равновесия 
Порядок химической реакции – показатель степени при концентрации этого вещества в уравнении реакции. Реакции нулевого порядка – So=Ko. Нулевой порядок характерен для гетерогенных реакций, если скорость диффузии реагентов меньше скорости их химического превращения.
Молекулярность реакции.
-число частиц, которые участвуют в химическом взаимодействии.
Мономолекулярные реакции – превращения одной молекулы (изомеризация, диссоциация) H2S=H+S
Бимолекулярные реакции – столкновения двух молекул (CH3Br+KOH=CH3OH+KBr)
Тримолекулярные (O2+NO+NO=2NO2)
Молярность характеризует механизм реакции. Порядок характеризует кинетическое уравнение реакции.
Порядок реакции
Реакция нулевого порядка


График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетическое уравнение имеет следующий вид:

Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.