 |
|
Приклади розв'язування задач
Приклад 1. Визначити еквіваленти (Е) та еквівалентні маси хлору, кисню і азоту у сполуках НСІ, H2О і NH3.
Розв'язування. Маса і кількість речовини — це не ідентичні поняття, оскільки маса речовини виражається у кілограмах (грамах), а кількість речовини — у молях.
Хімічним еквівалентом елементу називається така його кількість у молях, яка сполучається з одним молем атомів водню або заміщує таку саму кількість атомів водню у хімічних реакціях.
Еквівалентною масою називається маса одного еквівалента елементу (речовини). Таким чином, еквіваленти виражають у молях, а еквівалентні маси — у г/моль.
У наведених сполуках з одним молем атомів водню сполучається один моль атомів хлору, 1/2 моль атомів кисню і 1/3 моль атомів азоту. Таким чином, згідно з визначенням, еквівалент хлору, кисню та азоту дорівнюють відповідно 1 моль, 1/2 моль та 1/3 моль, тоді як їх еквівалентні маси: т(Сl)=35,45 г/моль, т(0)=16/2=8 г/моль, ГП(М)= 14/3=4,67 г/моль.
Приклад 2. Із 3,85 г нітрату металу одержано 1,60 г його гідроксиду. Обчислити еквівалентну масу металу mе.
Розв'язування. При розв'язуванні задачі потрібно мати на увазі, що:
а) еквівалентна маса гідроксиду дорівнює сумі еквівалентних мас металу та гідроксильної групи;
б) еквівалентна маса солі дорівнює сумі еквівалентних мас металу та кислотного залишку.
Еквівалентну масу будь-якої зарядженої частинки можна визначити, поділивши молекулярну масу на заряд. Наприклад:
me(NO3-) =62/1=62 г/моль, me(SO42-) =96/2=48 г/моль.
Тобто, за законом еквівалентів:

звідки me(Me) = 15 г/моль.
Приклад 3. Скільки грамів металу, еквівалентна маса якого 12,16 г/моль, взаємодіє з 310 мл кисню (н.у.)?
Розв'язування: Об'єм еквівалентної маси кисню (8 г/моль) дорівнюватиме:
 або 5600 мл.
або 5600 мл.
Приклад 4. На нейтралізацію 0,943 r фосфітної кислоти витрачено 1,288 г КОН. Обчислити еквівалент, еквівалентну масу і основність кислоти. На підставі розрахунку написати рівняння реакції.
Розв'язування: Еквівалентна маса КОН дорівнює його молярній масі – 56 г/моль. За законом еквівалентів:
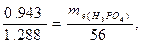 звідки
звідки

Молярна маса Н3РО3 дорівнює 82 г/моль. Тобто, еквівалент H3PO3 дорівнюватиме 41/82=0,5 моль; а її основність n дорівнює 2, таким чином, n=M/me. Отже, при взаємодії з КОН заміщується два атоми водню:
Н3РО3 + 2КОН = К2НРО3 + 2Н2О.
Приклад 5. При прожарюванні суміші ZnCO3 і ZnO масою 1,6 г добуто 1,248 г цинк оксиду. Який склад мала вихідна суміш (у масових частках)?
Розв'язування: а) Рівняння реакції розкладу:
ZnCO3 = ZnO + СО2
125 81 44
Як видно із рівняння реакції, 1 моль ZnCO3 (125 г/моль) втрачає 1 моль СO2 (44 г/моль). Різниця в масі за умовою задачі складає: 1,6 – 1,248=0,352 г.
Звідси:
125г ZnCО3 — 44г СО2
х — 0,352г СО2,
 г ZnCO3
г ZnCO3

 .
.
б) Виразимо масу ZnСО3 у суміші через х (г), тоді маси ZnO складе (1,6-х) г. Знайдемо масу ZnO, що утворюється при прожарюванні ZnCO3 масою х г:
із 125г ZnCO3 добувають 81г ZnO
х — У,
 (г)
(г)
За умовою задачі: 0,648х +(1,6 – х)= 1,248 г.
Звідси 1,6 – 1,248 = х – 0,648х, тоді 0,352 = 0,352х, х = 1 г, тобто маса ZnCO3 у суміші дорівнює 1 г, або:


Контрольні питання
1. Дайте назви таким сполукам: Na2O2, КО3, MgO, Mn2O7, СЮ, KHSO4, KHSO3, (CuOH)2CO3.
2. Дайте назву солям: K3AsO4, Na2Cr2O7, BaSO4, Ba(HSO4)2, CrOHSO4.
3. Напишіть формули ангідридів таких кислот: H2SO3, НClO3, НBrO, Н2МnО4, Н2Сr2О7. Дайте назву кислот і їх ангідридів.
4. Дайте назву таким сполукам: К2О2, МпО2, ВаО2, МnО, Сr2О3, CrO3, V2O5, Na2SO4, Na2S.
5. Які солі можна одержати, якщо мати у своєму розпорядженні CuSO4, AgNO3, K3P04, ВаС12? Напишіть рівняння реакцій і дайте назву одержаним солям.
6. Дайте назву солям: ВіОСl, [Al(OH)2]2SO4, (ZnOH)2CO3, Na2HPO4, NaHS.
7. Які солі можна одержати, якщо мати у своєму розпорядженні Na2SO4, AgNO3, Na3PO4, SrCl2? Напишіть рівняння реакцій і дайте назву одержаним солям.
8. Дайте назву солям: (CuOH)2CO3, KHS, K2S, BaCrO4, Са2Р2О7.
9. Напишіть формули оксидів, які відповідають наступним гідроксидам: Mg(OH)2, Al(OH)3) Fe(OH)2, КОН, Са(ОН)2. Дайте назву цим сполукам.
10. Дайте назву солям: Zn(NO3)2, NaH2SbO4, K2H2P2O7, CaCrO4, A1(OH)2N03. Наведіть приклади їх одержання.
11. Напишіть формули ангідридів таких кислот: H2SO4, НСЮ, Н2СО3, Н3В03, Н4Р207, НМп04. Дайте назву кислотам та їх ангідридам.
12. Дайте назву солям: NaCl, NaCIO, NaClO2, NaClO3, NaClO4. Наведіть приклади їх одержання.
13. Дайте назву солям: SbON03, A1OHSO4, Cd(HS)2, Ca(H2PO4)2, K4[Fe(CN)6]. Наведіть приклади їх одержання.
14. Дайте назву таким сполукам: S03, N2O, N2O3, C12O7, Ni(OH)2, Н3ВО3, Ті(ОН)3С1. Наведіть приклади їх одержання.
15. Напишіть формули кислотних оксидів, які відповідають кислотам: H2SeO4, H2Cr2O7, HMnO4, HNO3, HNO2, H3PO4, H2SO3. Дайте назву цим сполукам.
16. Дайте назву кислотам за традиційною, систематичною та раціональною номенклатурою: Н2МпО4, Н3РО4, НСlO3, НІ, HNO2.
17. Які оксиди відповідають основним, амфотерним, кислотним: А12О3, CaO, FeO, CO2, Mn2O7, P2O5, Fe2O3, SO3? Дайте назву оксидам.
18. Дайте назву таким сполукам: Ni(OH)NO3, MgNH4PO4, K2CO3, PbO, Hg(NO3)2, NaHCO3, Ba(OH)2.
19. Дайте назву комплексним солям: [Ag(NH3)2]Cl, K2[PC14], [Cu(NH3)4]SO4, [Сг(Н2O)6]С13.
20. Які оксиди можна одержати при нагріванні таких речовин: H2SiO3, Pb(NO3)2, Fe(OH)3, BaCO3, NaHCO3? Дайте назву вихідних речовин і одержаних оксидів.
21. При взаємодії 2,7 г оксиду металу з нітратною кислотою одержано 6,3 г його нітрату. Обчислити еквівалентну масу цього металу.
Відповідь: 32,5 г/моль.
22. На нейтралізацію 1,96 г Н3РО4 витрачено 2,4 г натрію гідроксиду. Обчислити еквівалент, еквівалентну масу та основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 1/3 моль; 32,666 г/моль; 3.
23. На відновлення 3,18 г оксиду двовалентного металу витрачено 0,896 л водню (н.у.). Обчислити еквівалентну, молярну та атомну масу металу.
Відповідь: 31, 75 г/моль; 63,5г/моль; 63,5 а.о.м.
24. На нейтралізацію 2,829 г Н3РО3 витрачено 3,864 г КОН. Обчислити еквівалент, еквівалентну масу та основність кислоти. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 41 г/моль: 2.
25. При взаємодії 3,24 г тривалентного металу з кислотою добуто 4,03 л водню (н.у.). Обчислити еквівалентну, молярну і атомну маси металу.
Відповідь: 9 г/моль; 27 г/моль; 27 а.о.м.
26. До розчину, який містить 4,1 г Н3РО3, додали 2 г натрію гідроксиду. Обчислити еквівалент, еквівалентну мису і основність H3РО3 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 82 г/моль; 1.
27. При відновленні воднем 10,17 г оксиду двовалентного металу утворилося 2,25 г води. Обчислити еквівалентні маси оксиду та металу. Чому дорівнює атомна маса металу?
Відповідь: 40,68 г/моль; 32,68 г/моль; 65,36 а. о.м.
28. На нейтралізацію 2,45 г кислоти витрачено 2 г натрію гідроксиду. Обчислити еквівалентну масу кислоти.
Відповідь: 49 г/моль.
29. При взаємодії 2,6 г гідроксиду металу з сульфатною кислотою одержано 5,7 г сульфату цього металу. Обчислити еквівалентну масу металу.
Відповідь: 9 г/моль.
30. До розчину, який містить 1,96 г Н3РО4, додали 2,24 г КОН. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь; 0,5 моль; 49г/моль; 2.
31. Оксид тривалентного елементу містить 31,58% кисню. Обчислити еквівалентну і атомну маси елементу.
Відповідь: 17,33 г/моль; 51,99 а.о.м.
32. На нейтралізацію 1,64 г Н3РО3 витрачено 1,6 г натрію гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО3. На підставі розрахунку написати рівняння реакції.
Відповідь: 0,5 моль; 41 г/моль; 2.
33. При відновленні 2,4 г оксиду металу воднем одержано 0,54 г води. Обчислити еквівалентні маси оксиду і металу.
Відповідь: 40 г/моль; 32 г/моль.
34. На нейтралізацію 0,98 г Н3РО4 витрачено 0,8 г натрію гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції.
Відповідь: 1/2 моль; 49 г/моль; 2.
35. При взаємодії 3,31 г нітрату металу з хлоридною кислотою одержано 2,78 г його хлориду. Обчислити еквівалентну масу цього металу.
Відповідь: 103,5 г/моль.
36. На нейтралізацію 2,64 г Н3РО2 витрачено 1,6 г натрію гідроксиду. Обчислити еквівалент, еквівалентну масу і основність Н3РО2. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 66 г/моль; 1.
37. Па окислення 3,24 г тривалентного металу витрачено 2,016 л кисню. Обчислити еквівалентну, молярну і атомну маси металу.
Відповідь: 9 г/моль; 27 г/моль; 27 а.о.м.
38. До розчину, який містить 4,9 г Н3РО4, додали 3,7 г кальцію дигідроксиду Са(ОН)2. Обчислити еквівалент, еквівалентну масу і основність Н3РО4 у цій реакції. На підставі розрахунку написати рівняння реакції і знайти, скільки грамів солі утворилось.
Відповідь: 1/2 моль; 49 г/моль; 2; 6,8г.
39. Знайти еквівалентні маси металу і сірки, якщо 3,24 г металу утворюють 3,48 г оксиду і 3,72 г сульфіду.
Відповідь: 108 г/моль; 16 г/моль.
40. На нейтралізацію 2,94 г H2SO4 витрачено 1,68 г КОН. Обчислити еквівалентну масу і основність кислоти. На підставі розрахунку написати рівняння реакції.
Відповідь: 1 моль; 98 г/моль; 1.
41. Сплав магнію з алюмінієм масою 1 г при взаємодії з кислотою виділяє 1,27 л водню при 25°С і тиску 750 мм.рт.ст. Обчислити відсотковий склад сплаву.
Відповідь: 29,9% Mg; 70,1% А1.
42. Обчислити, скільки відсотків метану у 36 мл його суміші з киснем, якщо після реакції суміш зменшилась у об'ємі на 1,8 мл (н.у.).
Відповідь: 2.5%.
43. Із 3 г суміші СаСОз і MgCO3 одержано 760 мл СО2 при 20°С і 748 мм.рт.ст. Обчислити відсоткове співвідношення мас СаСО3 і MgCO3.
Відповідь: 80,46% СаСО3.
44. Після вибуху 40 мл суміші водню і кисню залишилося 7 мл кисню. Виразити у відсотках об'єм кожного компонента первинного складу газової суміші.
Відповідь: 55% Н2; 45% О2.
45. При розкладі кальцію карбонату СаСО3 утворюється кальцій оксид і диоксид вуглецю. Обчислити, скільки літрів СО2 можна добути із 10,53 г СаСО3, який містить 5% домішок, що не розкладаються при нагріванні.
Відповідь: 2,14 л.
46. Вибухнула суміш водню і кисню об'ємом 50 мл. Після вибуху залишилося 8 мл кисню. Виразити у відсотках об'єм кожного компоненту первинного складу газової суміші.
Відповідь: 56% Ih; 44% О,.
47. У процесі розкладу магнію карбонату утворюється магній оксид і диоксид вуглецю. Знайти, скільки грамів магнію оксиду можна добути з 9,34 г магнію карбонату, який містить 10% домішок, що не розкладаються при нагріванні.
Відповідь: 4 г.
48. Скільки 100% нітратної кислоти НNО3 при 95%-му виході можна одержати в результаті окислення 20 м3 аміаку? Сумарне рівняння реакцій: NH3 + 2О2 = HNO3 + Н2О. Скільки кисню буде витрачено при цьому?
Відповідь: 53.4 кг HNO3 і 40 м3 O2,.
49. Для одержання марганцю із МnО2 алюмінотермією змішали 10,8 кг А1 та 26,2 кг МnО2. Яку із вихідних речовин взяли у надлишку? Рівняння реакції: 3МnО2 + 4А1 = 3Мn + 2А12O3.
Відповідь: 0,1 кг МпО2 (надлишок); 16,5 кг Мп.
50. Для відновлення 15,7 кг хром (III) оксиду витратили 5 кг алюмінію. Скільки хрому утворилося (відновилося) при цьому? Яку із вихідних речовин взяли у надлишку? Рівняння реакції: Сr2О3 + 2А1 = А12О3 + 2Сr.
Відповідь: 9,6 кг Сr; 1,63 кг Сr2Оз (надлишок).
51. Для одержання преципітату СаНРО4*2Н20 витратили 49 кг фосфатної кислоти Н3РО4. Скільки необхідно сухого кальцію дигідроксиду в даному випадку, якщо він містить 2% домішок? Рівняння реакції: Са(ОН)2 + Н3РО4 = СаНРО4 + 2Н2О.
Відповідь: 37,755 кг Са(ОН)3.
52. На виробництво 2 тонн залізного купоросу, що містить 52,5% FeSO4, витрачено 0,5 тонни залізного брухту. Який процент від теоретично можливого складає вихід FeSO4? Скільки сульфатної кислоти H2SO4 витрачено при цьому?
Відповідь: 77,37%; 1750 кг Н2SO4.
53. Обчисліть, скільки 100%-ної нітратної кислоти HNO3 може бути одержано із 1 тонни аміаку? Сумарне рівняння реакції: NH3 + 2О2 = HNO3 + H2O. Скільки кисню слід використати при цьому?
Відповідь: 3,7 тонни HNO3; 2,63*103 м3 O2.
54. Із однієї тонни хромістого залізняку Fe(CrO2)2 одержали 240 кг сплаву заліза з хромом – ферохрому, який містить 65% хрому. Обчисліть відсотковий вміст домішок у руді. Скільки хрому і заліза одержано при цьому, а також скільки вуглецю (коксу) витрачено на їх відновлення?
Відповідь: 66,4% домішок; 33,6% Fе(СrО2); 156 кг Сr; 8 4кг Fе; 72 кг С.
55. Скільки чавуну, який складається на 94% із заліза, можна виплавити із 1000 тонн червоного залізняку Fe2O3, що містить 20% пустої породи? Сумарне рівняння реакції:
Fe2O3 + 3СО = 2Fe + 3СО2. Скільки при цьому буде одержано заліза та витрачено вуглецю на утворення CO?
Відповідь: 595,75 тонни чавуну; 560 тонн Fe; 215,75 тонни С.
56. Скільки СаСО3, СаО і Н2О необхідно витратити, щоб одержати 1 тонну сухого кальцію дигідроксиду, якщо вихід його складає 90% від теоретично можливого? Рівняння хімічних реакцій: СаСO3 = СаО + СO2; СаО + Н2О = Са(ОН)2.
Відповідь: 1501,5 кг СаСО3; 840,84 кг СаО; 270,26 кг Н2О.
57. Суміш триамоній фосфату і амоній нітрату містить 30% азоту. Скільки відсотків фосфору міститься у суміші?
Відповідь: 15,2% Р.
58. При дії хлоридної кислоти НСІ на суміш порошку металічного цинку і його оксиду масою 7,3 г виділилося 1,12 л водню (н.у.). Скільки НСl було витрачено в реакції'?
Відповідь: 7,26 г НСІ.
59. У якому співвідношенні потрібно змішати оксид та гідроксид кальцію, щоб суміш містила 60% кальцію?
Відповідь: 34 г СаО; 66 г Са(ОН)2.
60. При прожарюванні 7,1 г суміші карбонатів кальцію і магнію добуто 3,8 г їх оксидів. Який відсотковий склад карбонатів?
Відповідь: 70,4% СаСО3.