 |
|
Приклади розв'язування задач
Приклад І. Користуючись даними табл. 1, обчислити ΔНх.р (хімічної реакції):
 2Mg(K) + СO2(г) 2MgO(к) + C(графіт).
2Mg(K) + СO2(г) 2MgO(к) + C(графіт).
Розв’язування: За даними табл. І стандартні ентальпії утворення СО2 та MgО відповідно дорівнюють -393,5 і 601,8 кДж/моль (слід запам’ятати, що стандартні ентальпії утворення простих речовин дорівнюють нулю).
За законом Гесса: "Стандартна зміна ентальпії хімічної реакції дорівнює сумі стандартних ентальпій утворення продуктів реакції за відрахуванням суми стандартних сіпальній утворення вихідних речовий". У кожному випадку необхідно враховувати кількість молей речовин, які беруть участі, у реакції (відповідно до рівняння реакції).
Звідси, для стандартної ентальпії даної реакції: ΔНх.р.=2ΔН0МgO – ΔН0СО2 = 2(-601,8)-(-393,5)=-1203,6+393,5 =-8 1 0, 1 кДж.
Приклад 2. Реакція горіння етилового спирту описується термохімічним рівнянням:
С2Н5ОН(Р) + 3О2(Г) = 2СО2(г) + 3Н2О(р); ΔН0х.р.=?
Обчислити тепловий ефект реакції, якщо відомо, що молярна теплота пароутворення C2Н5OH(p) дорівнює 42,36 кДж.
Розв’язування: Для визначення ΔН0х.р необхідно знати теплоту утворення C2H5ОН(p). Останню знаходимо таким чином;
С2Н5ОН(Р) à С2Н5ОН(г); ΔН0пароутворення = -42,36 кДж.
Звідки 42,36= -235,31 – ΔН0С2Н5ОН(Р);
ΔН0С2Н5ОН(Р)=-235,31 – 42,36=-277,67 кДж.
Знаходимо ΔНх.р, скориставшись висновком із закону Гесса:
ΔНх.р=2ΔН0СО2 + 3ΔН0Н2О(Р) – ΔН0С2Н5ОН(Р)=2(-393,5)+3(-285,8)-
(-277,67)=-1366,73 кДж.
Приклад 3. Реакція відновлення Fе2О3 воднем відбувається за рівнянням:
Fe203(K) + ЗН2(г) = 2Fe(K) + ЗН2О(Г); ΔНх.р=96,61 кДж.
При якій температурі почнеться відновлення Fe203, якщо зміна ентропії ΔS0=0,1387 кДж/(моль*К)?
Розв'язування. Оскільки в момент рівноваги ΔG0=0, a ΔН0=TΔS,
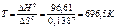
Отже, при температурі ≈696,5К почнеться реакція відновлення Fe2O3 (температура початку реакції).
Приклад 4. Знайти кількість теплоти, яка виділиться під час вибуху 12,6л гримучого газу (взятого за нормальних умов) з утворенням водної пари.
Розв'язувати. Запишемо термохімічне рівняння цієї реакції:
2Н2 + О2 à 2H2O; ΔН0х.р.=?
Тепловий ефект цієї реакції дорівнюватиме стандартній ентальпії утворення водяної пари:
ΔНх.р.=2ΔН0H2O = 2(-241,8)=-483,о кДж.
Оскільки в утворенні 2 моль води бере участь 3 моль газоподібних речовин (67,2 л), то:
67,2 л — (-483,6)
12,6 л — х,

Таблиця 1.
Стандартні ентальпії утворення ΔН0298, ентропії S0298 і енергії Гіббса ΔG0298 деяких речовин при 298 К (25°С).
| Речовина | ΔН0298, кДж/моль | S0298, Дж/(моль*К) | ΔG0298, кДж/моль |
| Al2O3 (к) | -1676,0 | 50,9 | -1582,0 |
| ВаСО3 (к) | -1176,76 | 112.1 | -1138,8 |
| ВаO (к) | 538,9 | 67,87 | -527.5 |
| ВеСО3 (к) | -944.75 | ||
| ВeО (к) | -581,61 | ||
| С(графіт) | 5,74 | ||
| С(алмаз) | 1,807 | 2.38 | |
| СH4 (г) | -74,9 | 186,2 | 50,8 |
| С2H2 (г) | 226,8 | 200,8 | 209,2 |
| С2Н4 (г) | 52,3 | 219,4 | 68,1 |
| С2Н6 (г) | 89,7 | 229,5 | -32,9 |
| CH3OH (р) | -238,7 | 126.7 | -167,22 |
| С2Н5ОН (p) | -277,67 | 160,7 | -174,8 |
| С2Н5ОН (г) | -235,31 | ||
| C6H6 (p) | 89,2 | 269,2 | 129,7 |
| С6H12O6 (глюкоза) | - 1273,0 | -919,5 | |
| СO (г) | -110,5 | 197,5 | -137,1 |
| CO2 (г) | 393,5 | 213,7 | -394,4 |
| СаСО3 (к) | -1207,0 | 88,7 | -1127,7 |
| СаО (к) | 635,5 | 39,7 | -604,2 |
| Речовина | ΔН0298, кДж/моль | S0298, Дж/(моль*К) | ΔG0298, кДж/моль |
| Са(ОН)2 (к) | 986,6 | 76,1 | -896,8 |
| СІ2 (г) | 222,9 | ||
| Сг2О3(к) | -1440,6 | 81,2 | -1050,0 |
| СuО (к) | -162,0 | 42,6 | -129,9 |
| Fe (к) | 27,15 | ||
| FeO (к) | -264,8 | 60,8 | -244,3 |
| Fе2O3 (к) | -822,2 | 87,4 | -740,3 |
| Fe3O4 (к) | -1117,1 | 146,2 | -1041,2 |
| H2 (г) | 130,5 | ||
| HCl (г) | -92,3 | 186,8 | -95,2 |
| H2О (г) | -241,8 | 188,7 | -228,6 |
| H2О (р) | -285,8 | 70,1 | -237,3 |
| H2S (г) | -21,0 | 205,7 | -33,8 |
| KC1 (к) | -435,9 | 82,6 | -408,0 |
| КСlO3 (к) | -391,2 | 143,0 | -289,9 |
| MgCO3 (к) | 65,69 | -1028,3 | |
| MgO (к) | -601,8 | 26,9 | -569,6 |
| N2 (г) | 199,9 | ||
| NH3 (г) | -46,2 | 192,6 | -16,7 |
| N2O (г) | 82,0 | 219,9 | 104,1 |
| NO (г) | 90,3 | 210,6 | 86,6 |
| NO2 (г) | 33,5 | 240,2 | 51,5 |
| N204 (г) | 9,6 | 303,8 | 98,4 |
| NiO (к) | -239,7 | 38,0 | -211,6 |
| О2 (г) | 205,0 | ||
| Р2О3 (к) | -820,0 | 173,5 | |
| Р2О5 (к) | -1492,0 | 1 14,5 | -1348,8 |
| PbO (к) | -219,3 | 66,1 | -189,1 |
| PbO2 (к) | -276,6 | 74,9 | -218,3 |
| PCl3 (г) | 311,66 | ||
| PCl5 (г) | 352.71 | ||
| CS2 (г) | 1 15,28 | 2-19,6 | 62,82 |
| NH4Cl (к) | -315,39 | 94,5 | -203,88 |
| ZnO (к) | -350,6 | 43,6 | -320,7 |
Контрольні питання
121. Знайти кількість теплоти, що виділиться під час вибуху 8.4 л гримучого газу, взятого за нормальних умов.
Відповідь: -60,45 кДж.
122. Реакція горіння етану описується термохімічним рівнянням:
С2Н6(r) + 3,5О2(r) = 2СО2 (r) + 3Н2О (р); ΔН0х.р.=-1559,87 кДж.
Знайти ентальпію утворення етану, якщо відомі теплоти утворення СО2 (r) і Н2О (р) (див. табл. 1).
Відповідь: -84,59 кДж.
123. Газоподібний етиловий спирт С2Н5ОН можна добути при взаємодії етилену С2Н4 (г) і водяної пари. Написати термохімічне рівняння цієї реакції, обчислити її тепловий ефект.
Відповідь: -45,81 кДж.
124. Водяний газ — це суміш рівних об'ємів водню і вуглець (II) оксиду. Знайти кількість теплоти, що виділиться при спалюванні 112 л водяного газу, який взято за нормальних умов.
Відповідь: -1322 кДж.
125. При взаємодії газоподібних сірководню і вуглець двооксиду утвЀся пари води і сірковуглеці. CS2 (г). Написати термохімічне рівняння цієї реакції, визначити її тепловий ефект.
Відповідь: 67,18 кДж.
126. При відновленні 12,7 г мідь (II) оксиду вуглецем з утворенням СО(г) поглинається 8,24 кДж теплоти. Знайти ΔН0298 утворення СuО (к).
Відповідь: -162,4 кДж/моль.
127. Чим можна пояснити, що за стандартних умов неможлива екзотермічна реакція: Н2 (г) + СO2 (г) = СO(г) + Н2О(р); ΔН0х.р=-2,85 кДж? Знаючи тепловий ефект реакції і абсолютні стандартні ентропії відповідних речовин, знайти ΔG0298 цієї реакції.
Відповідь: І9,98кДж.
128. При сполучені 2,1 г заліза з сіркою виділилось 3,77 кДж теплоти. Обчислити ентальпію утворення заліза (II) сульфіду.
Відповідь: -100,5 кДж/моль.
129. Кристалічний амоній хлорид утворюється при взаємодії газоподібних NН3 і НС1. Написати термохімічне рівняння цієї реакції, обчислити її тепловий ефект. Скільки теплоти виділиться, якщо у реакції було витрачено 10л аміаку, взятого за нормальних умов?
Відповідь: -78,97кДж.
130. Визначити стандартну ентальпію ΔН0298 утворення РН3, виходячи із рівняння:
2РH3 (г) + 4O2 (г) = P2O5 (к) + ЗН3О (р); ΔН0х.р=-2360 кДж.
Відповідь: 5,3 кДж/моль.
131. Тепловий ефект реакції горіння рідкого бензолу з утворенням рідкої води і вуглецю диоксиду дорівнює -3135,58 кДж. Скласти термохімічне рівняння цієї реакції і обчислити ентальпію утворення С6Н6 (р).
Відповідь: 82,82 кДж.
132. При взаємодії 6,3 г заліза з сіркою виділилось 11,31 кДж теплоти. Обчислити ентальпію утворення заліза (II) сульфіду.
Відповідь: -100,5 кДж/моль.
133. Обчислити, скільки теплоти виділиться при спалюванні 165л (н.у.) ацетилену С2Н2, якщо продуктами спалювання є СО2 і Н2О1(г).
Відповідь: -9248, 8 кДж.
134. Виходячи із теплового ефекту реакції:
3СаО (к) + Р205 (к) = Ca3(PO4)2; ΔН0х.р=-739 кДж, обчислити ΔН0298 утворення три кальцій дифосфату.
Відповідь: -4137,5 кДж/моль.
135. При повному згорянні етилену (з утворенням рідкої води) виділилося 6226 кДж теплоти. Знайти об'єм кисню, який вступив у реакцію (н.у.).
Відповідь: 296,5 л.
136. Реакція горіння метилового спирту описується термохімічним рівнянням: СН3ОН (р) + 1,5О2 (г) = CO2 (г) + 2Н2О (р); ΔН0х.р=? Обчислити тепловий ефект цієї реакції, якщо відомо, що молярна теплота пароутворення СН3ОН (р) дорівнює 37,4 кДж.
Відповідь: -726,40 кДж.
137. При згорянні газоподібного аміаку утворюються водянії пара і азот (II) оксид. Скільки теплоти виділиться у цій реакції, якщо добуто 44,8л NO (н.у.)?
Відповідь: -452,4 кДж.
138. Обчислити ΔН0298 реакції С2Н6(г) + 3,5О2(г) = 2СО2 (г) + 3Н2О (р) .
Відповідь: -1422,7 кДж.
139. Реакція горіння аміаку описується термохімічним рівнянням:
4NH3 (г) + 3О2 (г) = 2Н2 (г) + 6Н2О (р); ΔН0х.р=1530,28 кДж. Обчислити ентальпію утворення NH3 (г).
Відповідь: -46,13 кДж/моль.
140. При згорянні 1 л ацетилену (н.у.) виділилося 56,053 кДж теплоти. Написати термохімічне рівняння реакції, у результаті якої утворюються водяна пара і вуглець диоксид. Обчислити ентальпію утворення С2Н2 (г).
Відповідь: 226,75 кДж/моль.
141. При якій температурі настає рівновага у системі:
4НС1(г) + О2(г) =2Н2О(г) + 2СІ2(г); ΔН0х.р=-114,4 кДж?
Відповідь: 886,8 К.
142. Обчислити, при якій температурі почнеться дисоціація фосфор пентахлориду, яка відбувається за рівнянням:
РСІ5(г) =РСІ3(г) + С12(г) ; ΔН0х.р=92,59кДж.
Відповідь: 509 К.
143. Відновлення Fe3O4, вуглець оксидом відбувається за рівнянням: Fe3O4(к) + СО(г) = 3FcO(к) + CO2. Знайти ΔG0 і зробити висновок про самодовільний перебіг цієї реакції за стандартних умов. Чому дорівнює ΔS0 у цьому процесі?
Відповідь: 51 кДж; 52,4 Дж/моль К.
144. Визначити, при якій температурі почнеться реакція відновлення Fe3O4, яка описується рівнянням:
Fe3O4(к) + СО(г) = 3FcO(к) + CO2. ΔН0х.р=34,55кДж.
Відповідь: 659,35 К.
145. При якій температурі настає рівновага у системі
СН4(г) + СО2(г) = 2СО (г) + 2Н2(г); ΔН0х.р=247,34 кДж?
Відповідь: 965,9 К.
146. Які із карбонатів, ВеСО3 чи ВаСО3, можна добути при взаємодії відповідних оксидів з СО2? Зробити висновок, обчисливши ΔG0289 реакцій.
Відповідь: 31,26 кДж (реакція неможлива); —216,02 кДж (реакція можлива).
147. При якій температурі настає рівновага у системі:
СО(г) + 2Н2(г) = CH3ОН(р); ΔН0х.р=-128,05 кДж?
Відповідь: 385,9 K.
148. Які із перелічених оксидів можна відновити алюмінієм при 298 К: CaO, FeO, Сг2О3? Відповідь обґрунтувати, обчислити ΔG0х.р. .
Відповідь: FeO, Cr2O3.
149. Реакція відновлення Fe2O3 воднем описується рівнянням: Fe2O3(к)+ 3Н2(г) = 2Fe(к) + 3Н2О; ΔН0х.р=96,61 кДж. Чи можлива ця реакція за стандартних умов, якщо зміна ентропії ΔS0х.р=0,1387 кДж/моль*К? При якій температурі почнеться відновлення Fe2О3?
Відповідь: 696,5 К.
150. Обчислити значення ΔG0289 реакцій і установити, в якому напрямку вони перебігатимуть самодовільпо за стандартних умов (при 25°С): a) NiO(к) + РЬ(к) = Ni(K) + PbO(к);
б) РЬ(к) + СuО(к) = РЬО(к) + Cu(к).
Відповідь: а) 22.5 кДж; б) -59,2 кДж.
151. Обчислити ΔН0, ΔS0 і ΔG0 реакції, яка описується рівнянням: Fe2O3(к)+ 3С(к) = 2Fe(к) + 3СО(г). Чи можлива реакція відновлення Fe2O3 вуглецем при температурах 500 і 1000 К?
Відповідь: 220,7 кДж; —49,3 кДж.
152. Обчислити значення ΔG0289 реакцій і установити, у якому напрямку вони перебігають самодовільно за стандартних умов при 250С: а)8А1(к) + 3Fe3O4(к) = Fe(к) + 4А12О3(к);
б) Рb(к) + CuO(к) = РbО(к) + Сu(к).
Відповідь: -3204,4 кДж; -59,2 кДж
153. Які із оксидів можуть бути відновлені алюмінієм при 298 К: СаО, CuO, PbO, Fe2O3? Відповідь обґрунтувати, обчислити ΔG0х.р..
Відповідь: 230 кДж; -1192,3 кДж. -101-1,7 кДж; -841.7 кДж.
154. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовим обчислити ΔG0289 реакції, яка описується рівнянням:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(р). Чи можлива ця реакція за стандартних умов?
Відповідь: -131,01 кДж.
155. Порівняти ΔН0289 реакції відновлення залізо (III) оксиду різними відновниками при 298К: а) Fe2О3(к) + 3Н2 = 2Fе(к) 3CO2; б) Fе2O3(к) + 3СО(г) = 2Fе(к) + 3СO2(г).
Відповідь: 96,8 кДж; -26,8 кДж.
156. На підставі стандартних ентальпій утворення і абсолютних стандартних ентропій відповідних речовин обчислити ΔG0289 реакції: 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г). Чи можлива ця реакція за стандартних умов?
Відповідь: -958,4 кДж.
157. Обчислити ΔG0289 для реакції: СаСО3(к) = CaO(к) + CО2(г) при 25, 500 і 1500°С. Залежностями ΔН0х..р. та ΔS°х.р. від температури знехтувати.
Відповідь: 128,92 кДж; 50,7 кДж; -114,0 кДж.
158. Скориставшись довідниковими даними, показати, у якому напрямку відбуватиметеся реакція: Сu(к) + ZnО(к) = CuO(к) + Zn(к).
159. При одержанні еквівалентної маси кальцій дигідроксиду із СаО(к) і Н2О(р) виділяється 32,53 кДж теплоти. Скласти термохімічне рівняння цієї реакції і обчислити ентальпію утворення кальцій оксиду.
Відповідь: -635,7 кДж.
160. На підставі стандартних теплот утворення і абсолютних стандартних ентропій відповідних речовин обчислити ΔG0289 реакції, яка описується рівнянням:
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(р). Чи можлива ця реакція за стандартних умов?
Відповідь: -1331,4 кДж.