 |
|
Монооксид азота – оксид азота (П) - NO
Бесцветный газ, практически нерастворимый в воде. Обладает восстановительными свойствами и на воздухе приобретает бурую окраску (из-за образования диоксида азота).
1. Может быть получен при взаимодействии азота и кислорода:

Образование начинается при 15000. Хорошо образуется при 30000 – в атмосфере при грозовых разрядах.
2. В лаборатории:

Диоксид азота – оксид азота (IV) – NO2
Бурый ядовитый газ, имеет характерный запах, тяжелее воздуха, ядовит – раздражает дыхательные пути.
Получают:
1.Окислением оксида азота:

2. При прокаливании кристаллического нитрата свинца (П):

Азотистый ангидрид – оксид азота (Ш) – N2O3
Тёмно-синяя жидкость:
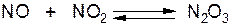
Азотистому ангидриду соответствует слабая азотистая кислота HNO2.
Азотный ангидрид – оксид азота (V) – N2O5
Твёрдое кристаллическое вещество, получается действием фосфорного ангидрида на азотную кислоту:

Азотистая кислота HNO2
2NO2 + H2O = HNO2 + HNO3
Соли получают в промышленности при взаимодействии оксидов азота и щёлочи.

Азотная кислота HNO3
В промышленности получают азотную кислоту тремя методами.
1.Из аммиака:
а) окисление аммиака на платиновом катализаторе:

б) окисление кислородом воздуха окиси азота:

в) поглощение NO2 водой в присутствии избытка кислорода:

2. Из воздуха («дуговой метод»).
Воздух сжигают при температуре 40000С. В качестве нагревателя использовано пламя электрической дуги.
3. Из селитры:

Соли азотной кислоты - нитраты
Нитраты натрия, калия, аммония и кальция называются – селитры.
Селитры используют главным образом как минеральные азотные удобрения.
Калиевую селитру (KNО3) применяют для приготовления чёрного пороха.
Из NH4NO3, порошка алюминия и угля изготовляют взрывчатое вещество – аммонал.
ФОСФОР
Электронный аналог азота N, электронная конфигурация его валентных электронов, как и у азота - sp3.
Относится к распространённым элементам. В природе встречается только в виде соединений. Важнейший: фосфат кальция – минерал апатит.
Для жизни фосфор имеет исключительное значение, так как входит в состав некоторых белковых веществ (в ткани мозга и нервов, в кости и зубы, в мышцы). Необходим фосфор для жизни растений.
Большое количество фосфора расходуется на производство спичек и в военном деле.