 |
|
Законы термодинамики
В основе термодинамики как науки лежат её первый и второй законы, устанавливающие качественные и количественные взаимосвязи между теплотой и механической работой [2].
Первый закон термодинамики устанавливает количественную связь между теплотой и механической энергиями и представляет собой балансовое уравнение изменения энергии в термодинамической системе:
u2 - u1 = q – l + a, (2.1.)
где (u2 – u1) - изменение удельной внутренней энергии;
q – удельная теплота c которой тело обменивается энергией с окружающей средой;
l – удельная работа по изменению объёма;
a – работа немеханического характера.
К работе немеханического характера можно отнести работу по переносу электрического заряда, работу (теплоту) химического взаимодействия и др.
Если считать, что a = 0, то u2 – u1= q – l. В математическом выражении первого закона термодинамики принято подводимую к телу теплоту выражать как функцию внутренней энергии и работы:
q =u2 - u1 + l, 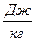 (2.2)
(2.2)
Тогда первый закон термодинамики с учётом(2.2.) формулируется следующим образом: вся подводимая к телу теплота идёт на изменение внутренней энергии и на совершение работы.
Отметим, что первый закон термодинамики, описывающий эквивалентное превращение теплоты и механической энергии, является частным случаем закона сохранения и превращения энергии, открытого М.В.Ломоносовым.
Запишем уравнение первого закона термодинамики в развёрнутом виде.
Из молекулярно-кинетической теории следует, что внутренняя энергия тела пропорциональна его температуре, тогда её изменение будет пропорционально разности температур, т.е.
U2 – U1 = cv (T2 – T1) (2.3)
Удельная работа расширения l в уравнении (2.2.) совершается против внешних сил, например расширение газа в цилиндре при постоянном давлении, и аналитически выражается следующим образом:
l = p (v2 – v1), (2.4)
где p – полное (абсолютное) давление газа, м3/кг.
С учётом уравнений (2.3) и (2.4) первый закон термодинамики можно представить в развёрнутом виде:
q = cv (T2 – T1)+ p (v2 – v1), 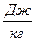 (2.5)
(2.5)
Уравнение (2.5) часто используется при описании работы теплоэнергетических машин и установок, а так же для анализа типовых термодинамических процессов в газах, которые являются частными случаями первого закона термодинамики.
Теоретически измененные состояния газа полностью характеризуются тремя параметрами p, v и T, при этом теплота либо подводится к газу, либо отводится от него.
Такие процессы называются политропными*. Наибольший практический интерес представляют такие процессы, в которых один из основных параметров остаётся постоянным, или процесс осуществляется без теплообмена с окружающей средой. Таких процессов в природе существует четыре:
- изохорный (v = const);
- изобарный (p = const);
- изотермический (T = const);
- адиабатный (dq = 0).
При исследовании термодинамических процессов обычно определяют:
- зависимости между изменяющимися параметрами газа;
- количество теплоты подводимой к рабочему телу;
- изменение внутренней энергии;
- работу расширения газа.
Все процессы при этом рассматриваются как равновесные и обратимые, а их исследование осуществляется на основе уравнения состояния идеального газа и первого закона термодинамики.
Изохорный процесс – это равновесный процесс, протекающий при постоянном объёме (v=const). Такой процесс осуществляется, например, при нагревании или охлаждении газа в замкнутом объёме. Так как в изохорном процессе не происходит изменение объёма, то уравнение первого закона термодинамики (2.5) при (v2 – v1) =0 будет иметь следующий вид:
q = cv (T2 – T1), 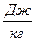 , (2.6)
, (2.6)
т.е. в изохорном процессе вся подводимая к телу теплота идёт на изменение его внутренней энергии.
Уравнение (2.6) определяет внутреннюю энергию 1кг газа в изохорном процессе, а его полная внутренняя энергия (m кг) определяется по уравнению (2.7): Q = cv m (T2 – T1), Дж (2.7)
В p–v координатах изохорный процесс изображается вертикальным отрезком (рис.2.1).
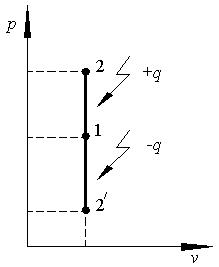 Рис. 2.1
Рис. 2.1
|
На рис. 2.1 процесс изохорного нагревания
1–2, а изохорного охлаждения 1-21. Площадь под линией изохорного процесса равна нулю, что свидетельствует об отсутствии работы.
Для построения графика изохорного процесса в T–s координатах используется выражение для энтропии:
ds = cv  , (2.8)
где dq = cvdT, тогда после интегрирования (2.8) в пределах температур от T1 до T2 c учётом, что dq = Tds получим: , (2.8)
где dq = cvdT, тогда после интегрирования (2.8) в пределах температур от T1 до T2 c учётом, что dq = Tds получим:
 (2.9) (2.9)
|
______________
* «поли» - много
Как следует из выражения (2.9), линия изохорного процесса в T–S координатах являются логарифмической кривой (рис 2.2).
В процессе 1 – 2 теплота подводится к рабочему телу и энтропия системы возрастает. Процесс 1-21 идёт с отводом теплоты а энтропия при этом уменьшается.

Рис. 2.2
 Рис. 2.3.
Рис. 2.3.
|
Изобарный процесс – это равновесный процесс, протекающий при постоянном давлении.
В p – v координатах изобарный процесс (рис. 2.3) представляет собой горизонтальный отрезок.
На рис. 2.3 в процессе 1–2 теплота q подводится к рабочему телу и совершается работа расширения. Для изобарного процесса уравнение первого закона термодинамики (2.5) применяется в общем виде, но вместо изохорной теплоёмкости cv используется изобарная, т.е. теплоёмкость при постоянном давлении cp :  (2.10) (2.10)
|
Тогда можно заключить, что в изобарном процессе часть подводимой к телу теплоты переходит в его внутреннюю энергию, а другая часть превращается в работу расширения.
Для построения изобарного процесса в T-s координатах подставим значение удельной теплоты q в общую формулу удельной энтропии для конечного процесса:
 (2.11)
(2.11)
 Рис. 2.4.
Рис. 2.4.
| Из уравнения (2.11) следует, что изобара как и изохора в T-S координатах изображается логарифмической кривой (рис.2.4), но угол наклона изобары меньше угла наклона изохоры, т.к. в заданном диапазоне температу cр  > >  . Следовательно, в одном диапазоне температур увеличение энтропии в изобарном процессе происходит быстрее, чем в изохорном. . Следовательно, в одном диапазоне температур увеличение энтропии в изобарном процессе происходит быстрее, чем в изохорном.
|
 Рис. 2.5
Рис. 2.5
| Изотермический процесс – это равновесный процесс (рис.2.5), протекающий при постоянной температуре (Т=const). График изотермического процесса в p-v координатах представляет собой равнобокую гиперболу, так как по закону Бойля-Мариотта при T = const имеем pv = const. На практике такой процесс можно осуществить путём подвода или отвода теплоты, сопровождающегося сжатием или расширением газа, находящегося под поршнем в цилиндре с идеально теплопроводными стенками. |
Очевидно, что в T – s координатах изотерма представляет собой горизонтальный отрезок прямой (рис.2.6), так как подвод и отвод теплоты не вызывает изменения температуры рабочего тела. В связи с тем, что при постоянной температуре внутренняя энергия тела не изменяется (T2 – T1 = 0), то вся подводимая к телу теплота расходуется на совершение работы.
Тогда первый закон термодинамики (2.1) будет иметь следующий вид:
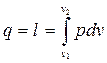 (2.12) С учетом уравнения состояния идеального газа можно принять
(2.12) С учетом уравнения состояния идеального газа можно принять  , тогда (2.12) можно записать следующим образом:
, тогда (2.12) можно записать следующим образом:
 Рис. 2.6.
Рис. 2.6.
|  (2.13) Уравнения (2.13) на практике часто используется для вычисления работы изотермического процесса.
Адиабатный процесс – это такой равновесный процесс, который совершается без теплообмена с окружающей
средой (dq=0), рис.2.7. Для него уравнение первого закона термодинамики
в дифференциальной форме может
быть представлено в следующем виде: (2.13) Уравнения (2.13) на практике часто используется для вычисления работы изотермического процесса.
Адиабатный процесс – это такой равновесный процесс, который совершается без теплообмена с окружающей
средой (dq=0), рис.2.7. Для него уравнение первого закона термодинамики
в дифференциальной форме может
быть представлено в следующем виде:
| |
 Рис.2.7.
Рис.2.7.
|  (2.14) Слагаемые в левой части этого уравнения представляют собой бесконечно малые величины изменения внутренней энергии и работы расширения. После замены переменных и интегрирования выражения (2.14) получим уравнение адиабаты в интегральной форме: (2.14) Слагаемые в левой части этого уравнения представляют собой бесконечно малые величины изменения внутренней энергии и работы расширения. После замены переменных и интегрирования выражения (2.14) получим уравнение адиабаты в интегральной форме:
 (2.15)
где (2.15)
где  - показатель адиабаты - показатель адиабаты
| |
На рис. 2.7 линия адиабаты круче изотермы, а удельная работа расширения l равна площади под кривой 1 – 2. Так как в адиабатном процессе подводимая теплота q равна нулю, то для совершения работы расширения используется часть внутренней энергии тела, т.е.  . Аналитически удельную работу расширения адиабатного процесса принято выражать через параметры p и v, как изменение удельной внутренней энергии с обратным знаком, т.е.: . Аналитически удельную работу расширения адиабатного процесса принято выражать через параметры p и v, как изменение удельной внутренней энергии с обратным знаком, т.е.:
 (2.16)
Необходимо отметить, что наряду с изменением внутренней энергии, работа адиабатного процесса зависит от показателя адиабаты k, значение которого для двух атомных газов равно 1,4. (2.16)
Необходимо отметить, что наряду с изменением внутренней энергии, работа адиабатного процесса зависит от показателя адиабаты k, значение которого для двух атомных газов равно 1,4.
| ||
 Рис. 2.8
Рис. 2.8
| В T–s координатах адиабата изображается вертикальной линией, т.к. из формулы для энтропии следует, что при dq = 0 измерение энтропии ds = 0, (рис. 2.8). В процессе 1– 21 происходит адиабатное сжатие, при котором температура тела повышается за счёт увеличения его внутренней энергии. Процесс 1–2 сопровождается адиабатным расширением с понижением температуры за счёт уменьшения внутренней энергии рабочего тела. Практически процесс приближённый к адиабатному осуществляется при быстром расширении (или сжатии) газа, находящегося под поршнем в цилиндре с изолированными от внешней среды стенками. Анализ типовых термодинамических процессов позволяет сделать вывод о том, что все эти процессы являются частными случаями общего уравнения первого закона термодинамики, а в уравнении изобарного процесса вместо изохорной теплоёмкости cv используется изобарная cp. | |
Сопоставляя уравнения четырёх рассмотренных процессов в p – v координатах можно установить, что они описываются произведением( p v) и отличаются друг от друга показателем степени при v :
- изохорный процесс  v = const (n =¥ ) ;
v = const (n =¥ ) ;
- изобарный процесс p = const (n = 0 ) ;
- изотермический процесс p v = const (n =1 ) ;
- адиабатный процесс p vk = const (n =k ).
Тогда все эти процессы можно описать одним обобщающим уравнением (2.17):
pvn = const, (2.17)
Такой обобщающий процесс называется политропным, а
n – показатель политропы.
Для наглядного сопоставления исследуемых процессов изобразим на одном рисунке все четыре графика, проходящие через общую точку 1 (рис. 2.9).
 Рис. 2.9
Рис. 2.9
| Очевидно, что через точку 1 можно провести бесконечное множество линий (процессов), называемых политропами, в пределах угла наклона ± ¥. Расчётные зависимости между параметрами состояния в любом политропном процессе аналогичны зависимостями, описывающим адиабатный процесс при n = k. Наличие гиперболических кривых на графиках политропных процессов значительно увеличивает трудоёмкость теплотехнических расчётов и снижает их точность. |
Поэтому, на практике принято представлять политропные процессы в логарифмических координатах (lg p – lg v), где графики всех процессов – прямые линии.
Для представления политропных процессов в логарифмических координатах логарифмируем уравнение (2.17):
lg p + n lg v= const (2.18)
Уравнение (2.18) с привязкой к выбранной системе координат можно записать в более удобном виде:
lg p= const - n lg v, (2.19)
где n – показатель политропы. На рис.2.10 видно, что графики термодинамических процессов в логарифмических координатах отличаются друг от друга значением угла α, а показатель политропного процесса n = tg α.
 Рис. 2.10
Рис. 2.10
| Как было отмечено ранее, первый закон термодинамики устанавливает количественную взаимосвязь между теплотой и механической энергиями, а условий взаимного превращения этих видов энергий он не определяет. Эту задачу решает второй закон термодинамики, который в |
дополнение к первому говорит о необратимости всех реальных процессов, об условиях превращения тепловой энергии в механическую и о направлении протекания того или иного процесса.
Из опыта известно, что теплота самопроизвольно может переходить только от более нагретых тел к телам менее нагретым, т.е. самопроизвольный (естественный) теплообмен обладает свойством направленности. Однако, в искусственных условиях возможен и обратный несамопроизвольный процесс: передача теплоты от менее нагретых тел к более нагретым. В этом случае для осуществления обратного процесса требуется подвести к телу внешнюю энергию. Примером такой энергетической установки может служить холодильник, в котором для осуществления обратного процесса используется электрическая энергия, преобразуемая в механическую, а за тем во внутреннюю энергию рабочего тела. Отмеченную особенность теплообмена впервые установил Р. Клаузис, который предложил первую формулировку второго закона термодинамики:
теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому, или некомпенсированный переход теплоты от тела с меньшей температурой к телу с большей температурой невозможен.
Отметим ещё одну особенность теплоты, которая состоит в том, что работа может полностью превратиться в теплоту (например, при трении), а для осуществления обратного процесса - превращения теплоты в работу, требуется какой-либо дополнительный процесс, или компенсация. Так для получения работы из теплоты в тепловых двигателях требуется периодическое повторение процессов расширения – сжигания, что сопровождается возвращением тела в исходное состояние с затратой некоторой работы.
На рис. 2.11. представлен круговой процесс работы (цикл) поршневого теплового двигателя в координатах р–v.В процессе (1- m – 2) при подводе теплоты q происходит расширение рабочего тела и совершается работа расширения  . В обратном процессе (2-n-1) теплота
. В обратном процессе (2-n-1) теплота  должна отводиться от рабочего тела в окружающую среду, на что затрачивается работа сжатия l2 равная площади
должна отводиться от рабочего тела в окружающую среду, на что затрачивается работа сжатия l2 равная площади  . Полезная работа ( l0 = l1- l2 ) равна площади замкнутой кривой цикла.
. Полезная работа ( l0 = l1- l2 ) равна площади замкнутой кривой цикла.
 Рис. 1.11. 1- цилиндр, 2 - поршень
Следовательно, для обеспечения достаточно длительной работы двигателя необходимо осуществлять круговой процесс, в котором, наряду с подводом тепла q к рабочему телу от горячего источника необходимо отводить теплоту q2 к холодному источнику, т.е. необходимо иметь разность температур. Изложенные теоретические предпосылки позволили французскому инженеру Сади Карно предложить вторую формулировку второго закона термодинамики: для получения из теплоты работы необходимо иметь разность температур. Тепловой двигатель, работающий только с одним верхним (горячим) источником теплоты, называется вечным двигателем второго рода. Рис. 1.11. 1- цилиндр, 2 - поршень
Следовательно, для обеспечения достаточно длительной работы двигателя необходимо осуществлять круговой процесс, в котором, наряду с подводом тепла q к рабочему телу от горячего источника необходимо отводить теплоту q2 к холодному источнику, т.е. необходимо иметь разность температур. Изложенные теоретические предпосылки позволили французскому инженеру Сади Карно предложить вторую формулировку второго закона термодинамики: для получения из теплоты работы необходимо иметь разность температур. Тепловой двигатель, работающий только с одним верхним (горячим) источником теплоты, называется вечным двигателем второго рода.
|
Тогда второй закон термодинамики можно сформулировать следующим
образом: вечный двигатель второго рода невозможен.
Действительно, если допустить существование теплового двигателя, который работал бы только за счёт охлаждения верхнего источника теплоты, то используя запасы внутренней энергии атмосферы или воды океана можно было бы получить неограниченное количество «даровой» энергии, т.е. запустить в работу вечный двигатель. Теоретические запасы тепловой энергии в мировом океане практически неисчерпаемы. По ориентировочным расчётам установлено, что использование тепловой энергии воды океана для питания всех энергоустановок земного шара охладила бы океан на 0,01оС за 1700 лет. В современных тепловых машинах воздух атмосферы и вода океана используются только в качестве нижних (холодных) источников теплоты, а верхние источники создаются искусственно за счёт сгорания органического топлива или ядерной реакции.
С точки зрения теории вероятностей определённая направленность самопроизвольных процессов и их необратимость объясняется стремлением системы перейти от неравновесного состояния к равновесному, как более устойчивому и вероятному. Тепловая энергия, передаваемая в процессе теплообмена, обусловлена хаотичным движением частиц вещества, а механическая энергия представляет собой упорядоченное движение структурных частиц. Теоретически можно представить, что упорядоченное движение может легко стать хаотическим как наиболее вероятным, а упорядочение хаотического движения связано с большими трудностями и затратой внешней энергии. Исходя из подобных теоретических предпосылок, в 1872 году Людвиг Больцман предложил ещё одну формулировку второго закона термодинамики, называемого принципом Больцмана: природные процессы стремятся перевести термодинамическую систему из состояний менее вероятных в состояния более вероятные.
Аналитически принцип Больцмана имеет следующий вид:
S = k ln W, (2.20)
где: S –энтропия, 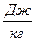 ;
;
k – постоянная Больцмана (k = 1,38·10-23 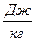 );
);
W – термодинамическая вероятность.
В соответствии с принципом Больцмана любые термодинамические системы стремятся к равновесному состоянию, для которого S и W максимальны.
Основными техническими характеристиками любой тепловой машины являются её мощность и коэффициент полезного действия (КПД). Теоретических ограничений мощности тепловых двигателей нет, а их КПД при заданных значениях температур верхнего и нижнего источников теплоты ограничен.
Для осуществления замкнутого процесса, в общем случае, следует привести несколько прямых и обратных процессов. Отметим, что на проведение обратных процессов тепловые двигатели не получают работы от окружающей среды, а используют некоторую часть произведённой ими работы расширения. Следовательно, что бы двигатель работал, работа расширения должна быть больше работы сжатия. На основе анализа термодинамических циклов С. Карно предложил идеальный цикл тепловой машины, имеющий наибольший КПД. Этот цикл состоит из двух изотерм и двух адиабат (рис. 2.12). Теплота q1 подводится по верхней кривой в процессе изотермического расширения (1-2). Далее в процессе (2-3) происходит адиабатное расширение, при котором температура уменьшается от T1 до T2. Обратные процессы (4-3) и (4-1) представляют собой изотермическое и адиабатное сжатие. Как следует из предыдущего цикла
(рис. 2.11), полезная работа цикла Карно l0 будет равна площади (1,2,3,4).
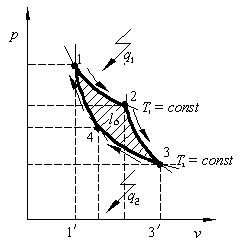 Рис. 2.12
Рис. 2.12
| Для более наглядного анализа КПД поcтроим цикл Карно в TS- координа- |
 Рис. 2.13
Рис. 2.13
| тах (рис.2.13). Здесь: площадь (4´,1,2,3´) – подведённая теплота q1, площадь (4´,4,3,3´) – отведённая теплота q2. Тогда площадь цикла (1,2,3,4) – теплота qo , превращённая в полезную работу, т.е. qo = q1- q2.. Отметим, что на p-v диаграмме горизонтальная линия прямого процесса расширения (1,2,3) должна проходить выше линии обратного процесса сжатия (3,4,1) |
и чем меньше работа сжатия, тем более экономично работает двигатель. Основной характеристикой экономичности любого цикла тепловой машины принято считать термический КПД, который равен отношению теплоты превращённой в работу ко всей подведенной в цикле теплоте (2.21)
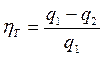 (2.21)
(2.21)
где:  - термический КПД;
- термический КПД;
q1 - подведённая теплота;
q2 - отведённая теплота.
С учетом формулы для определения энтропии термический КПД цикла можно выразить через температуры верхнего T1 и нижнего T2 источников
теплоты:
 (2.22) Из формулы (2.22) следует, что термический КПД цикла Карно не зависит от природы рабочего тела, а является функцией температур верхнего и нижнего источников теплоты. Отметим, что цикл Карно имеет наибольший термический КПД, так как в T-S координатах представляет собой прямоугольник, площадь которого в заданных диапазонах изменения энтропии и температуры будет больше площади любого другого цикла вписанного в этот прямоугольник.
(2.22) Из формулы (2.22) следует, что термический КПД цикла Карно не зависит от природы рабочего тела, а является функцией температур верхнего и нижнего источников теплоты. Отметим, что цикл Карно имеет наибольший термический КПД, так как в T-S координатах представляет собой прямоугольник, площадь которого в заданных диапазонах изменения энтропии и температуры будет больше площади любого другого цикла вписанного в этот прямоугольник.
Наряду с прямым циклом Карно существует и обратный цикл, в котором передача теплоты происходит от холодного источника к горячему путём затраты внешней энергии (холодильные установки). Степень совершенства обратного цикла Карно характеризуется холодильным коэффициентом  , который равен отношению подведённой теплоты q2 к работе цикла lо ( 2.23).
, который равен отношению подведённой теплоты q2 к работе цикла lо ( 2.23).
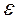 =
=  (2.23) Циклы холодильных установок рассмотрены в разделе 5.
(2.23) Циклы холодильных установок рассмотрены в разделе 5.
----------------------------------------
Теплопередача. Основы расчёта теплообменных аппаратов …….