 |
|
Термодинамическая характеристика раствора
РАСТВОРЫ ПОЛИМЕРОВ
Длительное время растворы ВМС относили к лиофильным коллоидным. Считалось, что дисперсная фаза в них состоит из мицелл-агрегатов макромолекул. Работы Каргина, Папкова, Роговина доказали, что растворы ВМС являются термодинамически обратимыми и, следовательно, истинными. Для растворов ВМС, так же как для коллоидных, характерны меньшие величины скоростей диффузии, осмотического давления, изменения температур замерзания и кипения по сравнению с растворами НМС. Интенсивность же светорассеяния растворов ВМС и коллоидных на несколько порядков больше по сравнению с растворами низкомолекулярных веществ. Растворы ВМС имеют специфические коллигативные свойства: большая вязкость и наличие стадии набухания растворяемого вещества, предшествующего растворению.
Концентрацию растворов ВМС обычно выражают в массовых, объемных долях или процентах растворенного вещества, а также числом граммов полимера в 100 мл раствора.
Термодинамическая характеристика раствора
В том случае, когда нужно охарактеризовать осмотическое давление раствора полимера в достаточно широком диапазоне концентраций, раствор нельзя рассматривать как идеальный с невзаимодействующими молекулами растворенного вещества. Химический потенциал растворителя в реальном растворе наилучшим образом может быть представлен степенным рядом, т.е. путем вириального разложения.
Применительно к разбавленному реальному раствору указанный подход приводит к следующему выражению для химического потенциала растворителя:
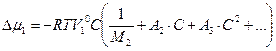 (1)
(1)
Зная что, 
 , зависимость осмотического давления раствора от концентрации растворенного вещества будет представлена следующим выражением:
, зависимость осмотического давления раствора от концентрации растворенного вещества будет представлена следующим выражением:
 , где (2)
, где (2)
А1, А2, ... являются константами, зависящими от температуры и природы растворенного вещества, которые называются вириальными коэффициентами.
Для теории растворов полимеров особое значение имеет второй вириальный коэффициент, обозначаемый как А2 или В. Под первым вириальным коэффициентом подразумевается первый член в скобках уравнения, равный 1/М2.
При достаточно малой концентрации полимера членами ряда в скобках, начиная с третьего, в уравнении (2) можно пренебречь, тогда:
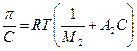 (3)
(3)
Уравнение (3) относится к уравнениям состояния, поскольку оно связывает значения параметров раствора и его термодинамических характеристик со свойствами, доступными для измерения, в данном случае - с осмотическим давлением.
Зависимость, вытекающая из уравнения (3), используется для термодинамической характеристики качества растворителя в растворе. На рис. 5.1 приведены три возможных случая (полуэмпирический параметр взаимодействия Флори - Хаггинса):
· кривые 1, 2 А2 > 0, χ < 1/2 - хороший растворитель;
· кривая 3 А2 = 0, χ = 1/2 - идеальный растворитель;
· кривая 4 А2 < 0, χ > 1/2 - плохой растворитель.

| Рис. 5.1. Зависимость приведенного осмотического давления раствора полистирола в циклогексане от концентрации: 1 - 50 °С; 2 - 40 оС; 3 - 35 °С (интерполяция); 4 - 30 °С |
Экспериментально найдено, что в хороших растворителях величина А2 обратно пропорциональна молекулярной массе полимера в степени 0,05 – 0,25, т.е. А2 ~ 1/М0,1. Состояние, отвечающее термодинамически плохому растворителю, реализуется в очень узком интервале, т.к. при Т < Θ раствор становится термодинамически неустойчивым и разделяется на две фазы.