 |
|
Опыт 2. Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры также изучают на примере реакции взаимодействия тиосульфата натрия с серной кислотой.
Концентрации растворов Na2S2O3 и H2SO4 остаются во всех опытах этой серии постоянными 0,2 н. Изменяем температуру, при которой проводим опыты. Делаем это следующим образом, В две пробирки наливаем по 3 мл растворов: в одну – Na2S2O3, в другую – H2SO4. Пробирки погружаем в стакан с горячей водой. Выдерживаем их в горячей воде 2...3 минуты. Считаем, что температура растворов равна температуре горячей воды в стакане. После выдержки в горячей воде растворы сливаем, быстро закрываем пробирку пробкой и энергично встряхиваем до появления опалесценции. Измеряем время протекания реакции.
Проводим несколько опытов (не менее трёx). Температуру горячей воды изменяем с интервалом 10°. Первый результат берём из табл.1 для комнатной температуры (опыт № I). Второй результат получаем при температуре на 10°С выше, третий - при температуры на 20°С выше комнатной и т.д. Интервал 10°С оставляем постоянным в целях удобства вычисления температурного коэффициента скорости реакции.
Полученные результаты заносим в табл.2.
Пользуясь значениями температурного коэффициента скорости реакции 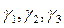 , вычисляем значения энергии активации исследуемой реакции
, вычисляем значения энергии активации исследуемой реакции 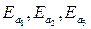 по уравнению (9), приведенному в разделе 2.2. Определяем среднее значение энергии активации.
по уравнению (9), приведенному в разделе 2.2. Определяем среднее значение энергии активации.
Таблица 2 – Зависимость относительной скорости реакции от температуры
| № о пыт а | Температура
опыта,  С С
| Время
протекания
реакции
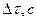
| Относит
скорость
реакции

| 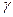 -темпе-
ратурный
коэффи-циент -темпе-
ратурный
коэффи-циент
|  -
среднее
значение
температурного
коэффи-циента -
среднее
значение
температурного
коэффи-циента
| 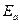 - энергия активации
реакции,
кДж/моль - энергия активации
реакции,
кДж/моль
|  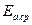 среднее
значение
энергии
активации
среднее
значение
энергии
активации
|

 +100 +100
 +200 +200
 +300 +300
|
По результатам этой серии опытов строим график зависимости 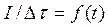
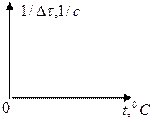
Делаем вывод.
В выводе отмечают характер полученной зависимости, сравнивают среднее значение температурного коэффициента с 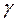 =2-4. Температурному коэффициенту
=2-4. Температурному коэффициенту 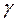 =2-4 соответствуют значения энергии активации 50-100 кДж/моль. Сравнивают полученное значение энергии активации с данной величиной.
=2-4 соответствуют значения энергии активации 50-100 кДж/моль. Сравнивают полученное значение энергии активации с данной величиной.