 |
|
ПОЯСНЕНИЯ К ЗАДАНИЯМ.
ПРАКТИКУМ
БИОФИЗИКА КЛЕТКИ
Кислородометрия
Биоэнергетика клетки
Кинетика ферментативного катализа
Проницаемость мембран
ЗАДАЧА № 6
ИССЛЕДОВАНИЕ КИНЕТИКИ ДЫХАНИЯ ДРОЖЖЕВЫХ КЛЕТОК ПОЛЯРОГРАФИЧЕСКИМ (АМПЕРОМЕТРИЧЕСКИМ) МЕТОДОМ
методические указания
Выпускникам ветеринарно-биологического факультета довольно часто приходится сталкиваться в своей работе (разумеется, тем которые остались верными своей специальности) с задачами регистрации кинетики дыхания, равно как и с задачами измерения активности ферментов. Где именно встают подобные задачи? Проблемы кислородометрии прежде всего возникают как задачи контроля параметров роста клеток в культурах при промышленном культивировании или при необходимости непрерывного контроля процессов вроде спиртового брожения. Возникают они и в чисто научных, а иногда и клинических исследованиях. Например, при измерениях дыхательной активности митохондрий (кстати сейчас в экологическом мониторинге довольно широко используют как тест-систему).
Практика показывает, что многие студенты академии сталкиваются уже при выполнении дипломных работ с названными задачами, причем кислородометрия вызывает порой методические затруднения, а о корректном определении активности фермента студенты просто не имеют понятия.
При выполнении настоящей задачи практикума студенты познакомятся с принципами измерения в кинетике ферментативного катализа, а также с техникой регистрации напряжения кислорода в растворах. В качестве конкретной задачи исследования предлагается выполнить за одно занятие одно или два из ЗАДАНИЙ по усмотрению преподавателя.
Каждое задание непременно включает одну и ту же задачу измерения - регистрировать динамику концентрации кислорода в водных средах, находящихся специальном сосуде - полярографической (электрохимической) ячейке, где могут находится дышащие или выделяющие кислород клетки. В ряде заданий (калибровки) вместо клеток используются другие агенты меняющие концентрацию кислорода в ячейке.
ВАРИАНТЫ ЗАДАНИЙ.
1. провести калибровку измерительного электрода по кислороду и определить численное значение коэффициента крутизны электрода.
2. определить активность по кислороду дыхательного ферментного ансамбля дрожжевых клеток (или сперматозоидов с/х животных) при сбраживании глюкозы.
3. определить активность по кислороду дыхательного ферментного ансамбля дрожжевых клеток (или сперматозоидов с/х животных) при сбраживании сахарозы.
4. определить энергию активации для заданий (2) и (3).Интервал температур уточнить у преподавателя.
5. определить коэффициент проницаемости мембран эритроцитов по кислороду в изотонических условиях.
6. то же, что и (5), но в гипотонических и гипертонических условиях.
7. измерить полярограмму восстановления кислорода на платиновом электроде.
ПОЯСНЕНИЯ К ЗАДАНИЯМ.
1. СТРУКТУРА ПОЯСНЕНИЙ .
Пояснения к заданиям состоят из разделов:
1. принцип метода (в предельно упрощенном виде).
2. конструкция установки.
3. методика регистрации полярограммы.
4. методика калибровки.
5. методика регистрации динамики дыхания клеток.
6. методика регистрации динамики выделения клетками кислорода.
7. как правильно измерять активность ферментов и в каких единицах.
8. как определять константу проницаемости мембран по кислороду.
9. как правильно измерять энергию активации ферментативных реакций.
10.как оформлять отчет.
Кроме того, в конце настоящего пособия имеются приложения, где может оказаться более подробная теория, а также всякие сведения по-поводу приготовления объектов и растворов, таблицы растворимости кислорода и т.п.
1.Принцип метода. ( в очень упрощенном виде!)
Если в сосуд с каким-либо изотоническим водным раствором (проще всего хлористого калия) опустить два стержня из проводников первого рода, причем чтобы площадь поверхности одного из них в десять (а лучше в десять тысяч) раз была больше площади поверхности другого, к маленькому электроду приложить -0.8 вольта относительно большого электрода, то сила тока при этом будет пропорциональна концентрации кислорода в ячейке. Материал электродов лучше всего взять химически инертный. Для большого электрода может подойти даже уголь, для маленького - платина или золото (вообще-то необязательно). Маленький электрод называется измерительным, большой - индифферентным или вспомогательным.

|
Рис.1. Схема простейшего устройства для измерения концентрации (парциального давления) кислорода в растворе.

|
Рис.2.Зависимость силы тока от парциального давления (концентрации) кислорода в растворе.
Часто вместо концентрации растворенного кислорода используют величину парциального давления кислорода - рО2. При одном и том же парциальном давлении кислорода над раствором - концентрация кислорода может оказаться действительно различной. Это зависит от растворимости кислорода, которая, в свою очередь, зависит от температуры, солености и т.п.
Однако, при постоянстве условий, согласно закону Генри (см. курс физ. химии) между парциальным давлением кислорода над раствором и концентрацией кислорода в растворе жесткая зависимость:

где К - коэффициент растворимости кислорода при данных условиях, размерность К - М/Па
Подробнее теорию метода можно прочитать в "ПРАКТИКУМЕ ПО физико-химическим методам в биологии" изд.МГУ 1981г. под.ред. Ф.Ф. Литвина.
При необходимости непрерывной регистрации концентрации кислорода в такой ячейке удобно воспользоваться полярографом к выходу которого подключен автоматический самопишущий потенциометр ( самописец). Принцип работы полярографа в режиме работы регистрации тока при постоянном потенциале должен быть ясен из рисунка 3. Последовательно с измерительным электродом включают резистор (вместо амперметра на рис.1). Сопротивление резистора невелико по сравнению с общим электрическим сопротивлением электрохимической ячейки. Падение потенциала на резисторе пропорционально току в ячейке. Величина падения потенциала на резисторе подается как входной сигнал на усилитель постоянного тока, к выходу которого подключен самописец. ЭДС на электродах поддерживается полярографом на заданном нами уровне с высокой стабильностью внутри полярографа встроен регулируемый источник стабилизированных ЭДС. Снимая сигнал не со всего резистора, а с его части можно менять общий коэффициент усиления.
Важной, для удобства пользователя, особенностью большинства промышленных полярографов является возможность сдвигать "0" в широких пределах:
из рисунка 2 видно, что даже при "нулевых" значениях концентрации кислорода в растворе - сила тока в ячейке отнюдь не равна 0. Кроме того, в процессе конкретного исследования может оказываться, что концентрация кислорода меняется в узких пределах - а хотелось бы растянуть эти изменения " на всю шкалу" регистрирующего прибора (самописца). Сдвинув "0" шкалы регистратора на значение тока соответствующее минимальному в предстоящем измерении. Затем подобрав усиление так чтобы максимальному значению тока в предстоящем измерении соответствовало 100% (или около) отклонения регистратора - можно "растянуть" кривую регистрируемого процесса на широкую шкалу.

|
Рис.3. Принцип регистрации тока в электрохимической ячейке посредством полярографа.
1- электрохимическая ячейка.
2- полярограф.
3- встроенный УПТ
4- резистор.
5- источник ЭДС.
6- самописец.
2. Конструкция установки.
Установка для регистрации динамики концентрации кислорода в растворе состоит из двух блоков:
a) полярографической ячейки с термостатом (рис.4 и рис.5) и
b) полярографа с самописцем.
Отличие реальной ячейки, от описанной выше упрощенной, состоит прежде всего в наличии термостатирования и наличии мешалки. Оба добавления являются принципиально необходимыми: обязательное условие измерительной процедуры при полярографическом измерении концентрации кислорода - это интенсивное перемешивание раствора, которое необходимо для ускорения установления диффузионного равновесия по кислороду в системе объект - рабочий объем раствора - электрод.

|
Рис.4. конструкция полярографической ячейки для регистрации динамики кислорода.
1-полярограф ЛП-7.
2- самописец полярографа.
3- термостатирующая рубашка ячейки.
4- ультратермостат.
5- электромеханическая мешалка.
6-среда инкубации.
7-измерительный электрод.
8-электролитический ключ заполненный хлористым калием.
9- сосуд индифферентного электрода, заполненный хлористым калием.
10- индифферентный электрод.
11- общая крышка.
12- воронка для подачи суспензии клеток в ячейку.
13- трубка для барботажа (подачи газов ) раствора.
Конструкция ячейки разъемная: камера для объекта крепится снизу к крышке со всеми ингредиентами с помощью двух защелок (рис.5)
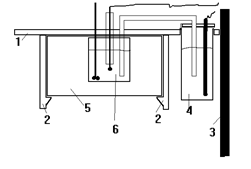
|
Рис.5. крепление ячейки на штативе
1- общая крышка
2- защелки
3- стойка штатива
4- вспомогательный (индифферентый) электрод
5- термостатирующая рубашка
6- камера с раствором.
Электроды подключены к полярографу LP-7. Переключатели полярографа установлены в режим регистрации тока при стабилизированном потенциале. Единственный переключатель, которым возможно придется пользоваться это переключатель чувствительности или степени усиления. Последний единственный орган управления на лицевой панели полярографа снабженный
поворотной рукояткой. Кроме того, на лицевой панели самописца находятся две рукоятки установки нуля (ZERO). Ими тоже иногда необходимо воспользоваться. Одна из рукояток для тонкой настройки нуля, другая - для грубой.
3 .Методика регистрации полярограммы.
Задание снято.
4. Методика калибровки.
Задание в классическом виде снято из-за отсутствия инертного газа.
Калибровку выполнять по дрожжевым клеткам.
Измерение проводить согласно методике регистрации динамики дыхания клеток (см.).
Исходный уровень парциального давления кислорода считать равным 159 мм.рт.ст. (сколько в Паскалях?). Уровень соответствующий концу дыхания клеток (рис.6) считать равным 15 мм.рт.ст. (Паскалей?).

|
Рис.6 примерный вид кривой динамики дыхания клеток, записанный на диаграммной ленте самописца.
Пользуясь полученной диаграммой легко найти СКОЛЬКО ММ ОТКЛОНЕНИЯ ПЕРА САМОПИСЦА СООТВЕТСТВУЮТ ИЗМЕНЕНИЮ ПАРЦИАЛЬНОГО ДАВЛЕНИЯ КИСЛОРОДА НА 144 ММ.РТ.СТ.
Считая кислородную зависимость силы тока измерительного электрода от парциального давления кислорода линейной можно вычислить коэффициент пересчета мм. отклонения пера в парциальное давление кислорода в Паскалях. Если же воспользоваться таблицей растворимости кислорода (см. приложение) то можно сразу и к концентрации кислорода перейти.
5. Методика регистрации динамики дыхания клеток.
Логическая схема регистрации динамики дыхания: "прописывают" на диаграммной ленте самописца исходный уровень кислорода в среде инкубации без клеток, затем вводят в малом объеме концентрированную суспензию клеток и ждут пока уровень сигнала не упадет до постоянной величины.
Порядок действий.
1. Включить все приборы и дать им прогреться.
2. Выставить на контактном термометре ультратермостат необходимую температуру (спросить у преподавателя) и дождаться ее установления в термостате.
3. Залить в камеру ячейки 50 мл среды инкубации. Если преподаватель не сделает спец. указаний - то среда инкубации 1% раствор сахарозы или глюкозы приготовленный на 0.15М KCl.
4. Установить камеру на штатив так, чтобы захлопнулись защелки.
5. Дождаться установления температуры в камере и включить лентопротяжный механизм самописца (тумблер "диаграмма" на лицевой панели самописца).
6. Дождаться успокоения системы - этому соответствует запись ровной вертикальной шумовой дорожки на ленте.
7. Через воронку в крышке камеры ввести в камеру строго отмеренное количество суспензии дрожжей в объеме не более 5 мл (лучше 1 мл).
8. Дождаться снижения сигнала до постоянного уровня и выключить лентопротяжный механизм.
9. Осторожно, чтобы не сломать защелки, снять камеру и вылить содержимое в стакан с надписью "СЛИВ". Дважды промыть камеру водой и один раз средой инкубации. Стаканом на 100 мл с чистой средой инкубации промыть электродную систему.
10.Если окажется, что перепад сигнала занимает малую часть шкалы диаграммной ленты можно произвести "растяжку шкалы" для последующих измерений меняя усиление и "0".
6.Методика регистрации динамики выделения клетками кислорода.
Задача снята.
7. Как правильно измерять активность ферментов и в каких единицах.
А также как обрабатывать результаты.
Определяют активность какого либо фермента, обычно, по скорости изменения концентрации соответствующего субстрата. При этом важно чтобы фермент был НАСЫЩЕН по субстрату. В этом случае, скорость реакции будет зависеть только от активности фермента. Последняя, в свою очередь, конечно, зависит от концентрации фермента, температуры, РН среды и т.п. Физико-химически параметры среды обычно стабилизируют: раствор "забуферивают" по РН, термостатируют реактор (сосуд, где идет ферментативный процесс). Концентрацию фермента условно задают по какому-либо удобному параметру, например, по количеству белка клеточной фракции, или по концентрации клеточных тел и т.п.
Если в реакции участвует более одного субстрата, то активность фермента определяют по скорости утилизации одного из субстратов, в отношении остальных лишь следят, чтобы все время наблюдения они были в избытке.
В нашем, конкретном, случае дышат дрожжи: концентрацию фермента удобно считать по числу клеток, субстратов два - кислород и глюкоза (или сахароза). Кислород в маленьком объеме ячейки кончается гораздо раньше, чем сбраживается глюкоза. Кстати это легко рассчитать надо только знать исходное количество кислорода - объем раствора 50 мл, исходное парциальное давление кислорода 159 мм.рт.ст.,при 25 градусах по Цельсию в 1 литре физ. раствора растворяется около 0.25*10-3 Моля кислорода. В 50 мл в 20 раз меньше - 0.125*10-4 Моля кислорода. А дальше всякий студент хоть чуть-чуть знающий химию сообразит сколько глюкозы или сахарозы может окислить такое количество кислорода.
Таким образом у нас осталась только одна проблема насыщенность ферментов по кислороду . Если ферменты насыщены по кислороду - то снижение концентрации кислорода должно быть линейной во времени зависимостью, то есть процессом идущей с постоянной скоростью. Зарегистрированный же на ленте процесс (рис.5) линейным не назовешь даже глядя невооруженным взглядом. Кроме того, в случае насыщенности ферментов по кислороду изменение количества фермента, например, вдвое должно сопровождаться аналогичным изменением скорости процесса.
В таких случаях поступают следующим образом. Полагая, что в самом начале процесса все же существовал момент, когда скорость процесса была постоянна ищут участок на кривой, который удовлетворительно соответствует названному этапу. При "ручной" обработке - это начальный участок динамики кислорода сразу после добавления клеток, до момента "загиба" кривой. При машинной обработке пользуются специальной программой обработки подобных кривых с поиском участка, для которого допустима линейная апроксимация с наперед заданной точностью. Можно, конечно так проделать и "вручную" на калькуляторе. В любом случае потребуются координаты нескольких точек начального участка кривой.
В каких единицах выражать активность ферментов? Как любую скорость реакции количество вещества в единице объема в единицу времени, но в отличие от обычной химии еще не единицу фермента.
Для тех кому непонятно, пример для конкретного случая задачи практикума: "в результате измерений определена активность ферментного ансамбля дрожжевых клеток (F.sp) 0.0004M/c*кл" . [Моль/(секунда*клетка)] или [0.0004 моля в секунду кислорода на 1 клетку].
И вообще, господа студенты, (кто пойдет в науки) учтите, что всякие там "относительные единицы" - это не лучший тон. По возможности всегда старайтесь в своих результатах найти ответ с РЕАЛЬНОЙ ФИЗИЧЕСКОЙ РАЗМЕРНОСТЬЮ.
Пример обработки отдельной кривой динамики кислорода.
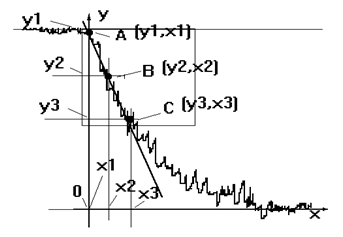
В качестве примера разберем обработку кривой уже показанной на рис.6, необходимый фрагмент ее теперь показан увеличенным:
|
Рис.7. Обработка кривой динамики кислорода (дыхание клеток).
1. Участок кривой, для которого, как мы полагаем, допустима линейная апроксимация выделен квадратом. На нем выбраны три точки: А, В, С; координаты названных точек находим опуская соответствующие перпендикуляры. Координаты обозначены Уi и Хi. Размерность координат точек миллиметры. Кстати, сразу отметим, что координата Х1 точки А соответствует началу отсчета времени и ее значение равно 0 (момент внесения клеток).
При внесении клеток иногда бывает на кривой "всплеск" связанный с возмущением среды, при расчетах им пренебрегают экстраполируя данный участок к начальному уровню кислорода.
2. Целесообразно сразу координатам придать физическую размерность, чтобы потом ничего не путать. Если есть готовая программа обработки, она запросит лишь координаты точек (сама скажет каких и сколько надо), а все остальное сделает сама, но то же самое, что здесь описано, может только получше.