 |
|
Расчет равновесий по экспериментальным данным
Для гомогенной химической реакции в газовой фазе
A A + b B = d D + g G (4)
условием равновесия является равенство нулю суммы химических потенциалов всех компонентов:
 . (5)
. (5)
Химический потенциал компонента есть функция его парциального давления:
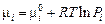 . (6)
. (6)
Здесь  - химический потенциал i-го компонента в стандартном состоянии (при Рi = 1 атм), является функцией только температуры.
- химический потенциал i-го компонента в стандартном состоянии (при Рi = 1 атм), является функцией только температуры.
Из уравнения (5) следует, что
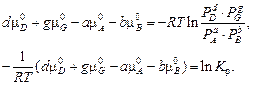
Отсюда
 (7)
(7)
Выражение (7) представляет собой закон действующих масс. Kр – константа равновесия, она зависит только от температуры и не зависит от парциальных и общего давлений.
Постоянство Kрпри постоянной температуре означает, что постоянно соотношение между парциальными давлениями компонентов, а состав газовой фазы в общем случае может меняться. Изменение парциального давления хотя бы одного из веществ влечет за собой изменение парциальных давлений всех остальных, но таким образом, чтобы Kр оставалась постоянной.
Константу равновесия Kр можно выразить также через равновесные концентрации компонентов, числа моль и мольные доли, выразив эти величины через парциальные давления:

Если обозначить через
 ;
;  ;
; 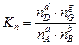 ,
,
получим:
 ;
;  ;
;
 при ∆n ≠ 0.
при ∆n ≠ 0.
Здесь ∆n – изменение числа моль газообразных участников реакции, ∆n = d + g – a – b.
Для гетерогенных реакций с участием газообразных веществ константа равновесия Kр выражается только соотношением парциальных давлений газообразных реагентов, так как давления насыщенных паров твердых и жидких веществ, участвующих в реакции, не зависят от их количества, а зависят только от температуры и при постоянной температуре остаются постоянными. Их можно внести в константу равновесия. Например, для реакции
aAтв + bBг = dDтв + gGг,  .
.
При расчетах равновесий по экспериментальным данным возникает необходимость находить степень превращения веществ. Степенью превращения вещества в химической реакции называется отношение числа моль вещества, вступившего в реакцию, к исходному числу моль этого вещества. Так, если в реакции (4) было взято nA моль вещества A, nB моль вещества В и образовалось Х моль вещества D и Х моль вещества G, то степени превращения исходных веществ А и В выразятся уравнениями:
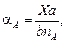
 .
.
Расчет равновесий по экспериментальным данным обычно сводится к определению состава равновесий смеси газов по константе равновесия или, наоборот, к нахождению константы равновесия по начальной нестехиометрической смеси газов и степени превращения.
Пример 11
При 1000 К и 1,013 · 105 Н/м2 из исходной смеси, содержащей 1 моль SO2 и 0,6 моль О2, при достижении равновесия образовалось 0,22 моль SO3 . Определить KР для реакции
2SO2 + O2 = 2SO3
Решение
На образование 0,22 моль SO3, согласно уравнению реакции, израсходовано 0,22 моль SO2 и 0,11 моль O2 .
Записываем число моль реакции:
2SO2 + O2 = 2SO3
в исходной смеси: 1 0,6 0
в равновесной смеси: 0,78 0,49 0,22
Отсюда




Константа равновесия равна
 .
.
Пример 12
Для реакции  при 503 К KР = 1,28 ´
при 503 К KР = 1,28 ´
´ 106 (Н/м2) -1 . Определить состав равновесной смеси в объемных процентах, полученной при давлении 1,013 · 106 Н/м2 из 2 моль С2Н4 и 1 моль HCl.
Решение
Обозначим через Х число моль образовавшегося С2Н5Сl. Так как на образование его должно быть израсходовано, согласно химическому уравнению реакции, по Х моль С2Н4 и HCl, то в равновесной смеси останется 2 – Х моль С2Н4 и 1 – Х моль HCl.
Запишем число моль:
С2Н4 + HCl = С2Н5Сl
в исходной смеси: 2 1 0
в равновесной смеси: 2 – Х 1 – Х Х
Отсюда ∑n = 2 – Х + 1 – Х + Х = 3 – Х .
Для парциальных давлений компонентов получаем выражения:
 ;
;  ;
;  .
.
Тогда

После преобразований получаем
2,32 Х2 – 6,96 Х + 2,04 = 0.
Решая квадратное уравнение, находим Х1 = 0,44 и Х2 = 2,55 .
Так как Х < 1 из условия, второй корень не имеет физического смысла. Значит, Х = 0,44. Таким образом, в равновесной смеси содержится (2 – 0,44) = 1,56 моль С2Н4, (1 – 0,44) = 0,56 моль HCl и 0,44 моль С2Н5Сl. Состав смеси в объемных процентах определяется из соотношений:
 ;
;
 ;
;

Пример 13
При 573 К для реакции Сграфит + 2Н2 = СН4 константа равновесия равна KР = 1,53·10-3 (Н/м2)-1. Вычислить содержание метана в объемных процентах в равновесной смеси при указанной температуре и давлении 1,013 × 106 Н/м2.
Решение
Для рассматриваемой гетерогенной реакции
 ,
,
учитывая, что  , получим
, получим
 .
.
Решая полученное квадратное уравнение, получим
 ,
,
подставляем значения Р и KР в данное уравнение и получаем



Пример 14
Константа равновесия реакции 2CuCl + H2 = 2Cu + 2HCl равна KР = 2,13 × 105 Н/м2 . Сколько граммов меди образуется, если газовая фаза до начала реакции состояла из 0,1 моль Н2  и 0,02 моль HCl (nHCl)? Общее давление в состоянии равновесия равно Р = 1,013 · 105 Н/м2.
и 0,02 моль HCl (nHCl)? Общее давление в состоянии равновесия равно Р = 1,013 · 105 Н/м2.
Решение
Константа равновесия данной гетерогенной реакции выражается уравнением
 ,
,
где  и
и  - парциальные давления HCl и H2.
- парциальные давления HCl и H2.

где  и
и  - мольные доли HCl и H2.
- мольные доли HCl и H2.
 ,
,
где  .
.
Тогда:



После преобразований получаем уравнение
Х2 + 0,02Х – 0,00406 = 0.
Положительное значение корня: Х = 0,0545. Значит, nравнCu = = 2X = 0,109 моль, gCu = 0,109 × 63,546 = 6,923 г.
3.2. Расчеты по уравнениям изотермы, изобары
и изохоры химической реакции
Изменение изобарного потенциала при протекании химической реакции в газовой фазе: aA + bB = gG + rR при Р, Т = const можно вычислить по уравнению изотермы Вант-Гоффа:
 .
.
При V, T = const уравнение изотермы позволяет вычислить изменение изохорного потенциала:

По знакам ∆G и ∆F можно судить о возможности и направлении протекания данной реакции. Если ∆GP, T < 0 или ∆FV, T < 0, реакция может протекать самопроизвольно в прямом направлении.
Зависимость константы равновесия от температуры выражается уравнениями изобары и изохоры Вант-Гоффа:
 или
или  ;
;

 или
или  .
.
В небольших температурных интервалах можно принять, что ∆Н ≠ f(T), тогда в интегральной форме уравнение изобары имеет вид

Графически в координатах  это уравнение изображается прямой линией, тангенс угла наклона которой равен
это уравнение изображается прямой линией, тангенс угла наклона которой равен

Постоянная интегрирования j определяется отрезком, отсекаемым прямой на оси ординат, или вычисляется по формуле
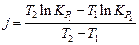 .
.
Интегрируя в пределах от Т1 до Т2, получаем
 .
.
Это уравнение позволяет вычислять ∆Н в небольших интервалах температур, если известны значения констант равновесия при двух температурах. При более точном интегрировании следует учитывать, что ∆Н = f(T).
Пример 15
Степень диссоциации фосгена по реакции СОCl2 = CO + Cl2 при 873 К и 1,38 · 105 Н/м2 равна 0,9. Определить, в каком направлении будет протекать процесс при следующих заданных значениях парциальных давлений компонентов:
| № п/п |  , Н/м2 , Н/м2
|  , Н/м2 , Н/м2
|  , Н/м2 , Н/м2
|
| 1,013 | 1,013 | 1,013 | |
| 1,048 | 2,026 | 3,039 | |
| 1,048 | 3,039 | 3,039 |
Решение
Определяем константу равновесия реакции
СОCl2 = CO + Cl2:
n(1 - α) nα nα


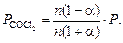
Подставим в уравнение для KР :

Направление процесса определяем по ∆G из изотермы химической реакции. В первом случае
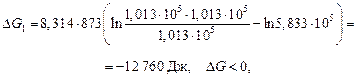
значит, процесс идет самопроизвольно в прямом направлении.
Во втором случае

значит, система находится в равновесии.
В третьем случае

значит, процесс идет самопроизвольно в обратном направлении.
Пример 16
Возможен ли термодинамический процесс получения анилина из хлорбензола по уравнению  , если известны стандартные изменения изобарного потенциала веществ, входящих в данную реакцию:
, если известны стандартные изменения изобарного потенциала веществ, входящих в данную реакцию: 
 ,
,  ,
, 
 ,
,  .
.
Вычислить Kр реакции при 298 К.
Решение
1.  ,
,
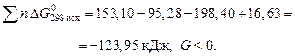
Следовательно, процесс возможен.
2. Kр вычисляется по уравнению изотермы для нормального сродства:
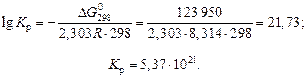
Пример 17
Рассчитать констант равновесия реакции СО + 2Н2 = СН3ОНг
при 800 К, если  ,
,  и мольные теплоемкости газов:
и мольные теплоемкости газов:

Решение
Определяем тепловой эффект по уравнению Кирхгофа:



Константу равновесия определяем по формуле


Пример 18
Константа равновесия реакции  может быть выражена уравнением
может быть выражена уравнением

Определить тепловой эффект этой реакции при 1000 К и KР.
Решение
Зависимость константы равновесия от температуры описывается уравнением изобары:
 .
.
Для определения ∆Н необходимо продифференцировать уравнение  по температуре и полученную зависимость умножить на 2,303 R T2 .
по температуре и полученную зависимость умножить на 2,303 R T2 .


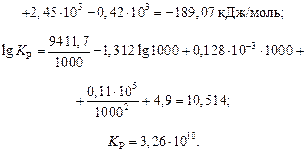
3.3. Расчет равновесий по таблицам стандартных величин
и методом Темкина – Шварцмана
Стандартное изменение изобарного потенциала выражается уравнением
 .
.
Отсюда


или
 .
.
Для расчета константы равновесия при любой температуре используют уравнение
 ,
,
где

Подставляя значения  и
и 
 в уравнение для lgKp, T и преобразуя его, можно получить
в уравнение для lgKp, T и преобразуя его, можно получить
 ,
,
где М0, М1, М2 и М–2 – функции температуры.
 ;
;  при n ≠ 0.
при n ≠ 0.
Указанные коэффициенты могут быть найдены по таблице, составленной М.И. Темкиным и Л.А. Шварцманом. Расчеты при использовании метода Темкина – Шварцмана значительно упрощаются.
Таким образом, для расчета константы равновесия по стандартным термодинамическим данным необходимо:
1. Найти в справочной литературе для всех участников реакции: 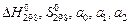 и а-2.
и а-2.
2. Рассчитать для реакции  и Δа-2 путем вычитания из суммы соответствующих величин для конечных продуктов суммы этих величин для исходных веществ с учетом стехиометрических коэффициентов уравнения химической реакции.
и Δа-2 путем вычитания из суммы соответствующих величин для конечных продуктов суммы этих величин для исходных веществ с учетом стехиометрических коэффициентов уравнения химической реакции.
3. Найдя по таблицам Темкина – Шварцмана значения М0, М1, М2 и М-2 для своей температуры Т, рассчитать Kp, T.
Пример 19
Вычислить константу равновесия по методу Темкина –Шварцмана для реакции  в газовой фазе при 1200 К. Полученное значение константы равновесия сравнить с экспериментальным
в газовой фазе при 1200 К. Полученное значение константы равновесия сравнить с экспериментальным 
Решение
Находим из справочника значения 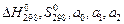 и Δа2 для Н2, СО, СО2 и СН4. Данные записываем в виде таблицы:
и Δа2 для Н2, СО, СО2 и СН4. Данные записываем в виде таблицы:
| Вещество | 
| 
| а0 | а1 .103 | а2 .106 | а–2 .10-5 |
| Дж/(моль·К) | ||||||
| СО | -110,50 | 197,40 | 28,41 | 4,10 | – | -0,460 |
| Н2 | 130,60 | 27,28 | 3,26 | – | 0,502 | |
| СН4 | -74,85 | 186,20 | 17,45 | 60,46 | 1,17 | – |
| СО2 | -393,50 | 213,60 | 44,14 | 9,04 | – | 8,530 |
По данным таблицы вычисляем:




По таблице Темкина – Шварцмана при Т = 1200 К находим:
М0 = 0,641, М1 = 0,339 · 103 , М2 = 0,203 .106 , М-2 = 0,318 .10-5 .
По приведенной выше формуле находим:

Таким образом, Kр, 1200 = 3,127·103,  вычисляем расхождение между расчетными и экспериментальными данными:
вычисляем расхождение между расчетными и экспериментальными данными:

Список литературы
Основной
1. Курс физической химии / Под ред. Я.И. Герасимова. – 2-е изд. – М.: Химия, 1969. – Т. 1. – 592 с; М.: Химия, 1973. – Т. 2. – 623 с.
2. Киреев В.А. Курс физической химии. – М.: Химия, 1975. – 775 с.
3. Жуховицкий А.А., Шварцман Л.А. Физическая химия. – М.: Металлургия, 1976. – 543 с.
4. Киселева В.Е., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – М.: Высш. шк., 1983. – 456 с.
5. Пономарева К.С. Сборник задач по физической химии. – М.: Металлургия, 1962. – 232 с.
6. Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.М. Пономаревой. – Л.: Химия, 1983. - 232 с.
Дополнительный
1. Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высш. шк., 1988. – 479 с.
2. Даниэльс Ф., Олберти Р. Физическая химия. – М.: Мир, 1978. – 645 с.
3. Крестовников А.Н., Вигдорович В.Н. Химическая термодинамика. – 2-е изд. – М.: Металлургия, 1973. – 256 с.
4. Карапетьянц М.Х. Химическая термодинамика. - 3-е изд., перераб. и доп. – М.: Химия, 1975. – 584 с.
5. Краткий курс физической химии / Под ред. С.Н. Кондратьева. - 2-е изд. – М.: Высш. шк., 1978. – 312 с.
6. Картушинская А.И., Лельчук Х.А., Стромберг А.Г. Сборник задач по химической термодинамике. – М.: Высш. шк., 1973. – 222 с.
7. Карапетьянц М.Х. Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. – М.: Химия, 1968. – 470 с.
Содержание
Введение............................... 3
1. Первый закон термодинамики................... 3
1.1. Термодинамические процессы................. 3
1.2. Теплоемкость. Зависимость теплоемкости от температуры ... 7
1.3. Закон Гесса .......................... 9
1.4. Зависимость теплового эффекта химической реакции от темпе-
ратуры ............................. 13
2. Второй закон термодинамики................... 15
2.1. Вычисление изменения энтропии в различных процессах .... 15
2.2. Вычисление изменения изобарного и изохорного потенциа-
лов в различных процессах.................. 19
3. Химическое равновесие...................... 21
3.1. Расчет равновесий по экспериментальным данным....... 21
3.2. Расчеты по уравнениям изотермы, изобары и изохоры хими-
ческой реакции......................... 29
3.3. Расчет равновесий по таблицам стандартных величин и мето-
дом Темкина – Шварцмана................... 35
Список литературы.......................... 38
 | |||
 |
1,5
1,96
3,82
0,7
0,01

Редактор Н.А. Бачурина
Компьютерная верстка Н.А. Бачуриной
Лицензия А № 001633 от 2 февраля 2004 г.
 |
Сдано в набор 02.09.05 г. Подписано к печати 16.09.05 г.
Тир. 25 экз. Уч.-изд. л. 2. Формат 60´841/16. Усл. печ. л. 2,56.
Гарнитура Таймс. Зак.
 |
 162600, г. Череповец, пр. Луначарского, 5
162600, г. Череповец, пр. Луначарского, 5
 ГОУ ВПО Череповецкий государственный университет
ГОУ ВПО Череповецкий государственный университет